- Сборка мебели своими руками подробная инструкция
- Мебельный крепеж разновидности, плюсы и минусы каждого типа
- Какая понадобится фурнитура для сборки шкафов, обзор
- Саморезы для сборки мебели: преимущества и недостатки
- Саморезы для сборки мебели: преимущества и недостатки
- Особенности
- Виды мебельных соединений
- Саморезы для ДСП
- Шуруп со сверлом, шлицем типа torx и потайной головкой
- Шуруп со шлицем типа torx и полукруглой головкой
- Саморез со шлицем типа torx и потайной головкой
- Саморез со шлицем типа torx и полупотайной головкой
- Саморез со шлицем типа torx, широкой полукруглой головкой и неполной резьбой
- Саморез со шлицем типа torx, широкой полукруглой головкой и полной резьбой
- Саморез со шлицем «крест» Pz, полной резьбой и полукруглой головкой
- Саморез со шлицем «крест» Pz, полной резьбой и полупотайной головкой
- Саморез со шлицем «крест» Pz, полной резьбой и потайной головкой
- Фосфатированные саморезы
- Конфирмат
- Почему и когда необходимо засверливание?
- Крепление ДСП к стене
- Таблица для выбора самореза в зависимости от нагрузки на одну точку крепежа
- Инструмент для крепления изделий из ДСП
- Мебель на саморезах — Заметки о мебели
- Мебельный крепеж. Виды и применение. Особенности и материал
- Мебельные стяжки: Минификсы, Рафиксы, Конфирматы.
- Как правильно выбрать кухню?
- Модульная сборка массивов CRISPR в одном горшке позволяет создавать библиотеки и выявлять факторы, влияющие на биогенез crRNA
- Штаммы и условия роста
- Создание массивов CRISPR в одном горшке
- Создание библиотеки массивов CRISPR в одном горшке
- Плазмидный клиренс в
- Репрессия гена в
- Обнаружение мультиплексной РНК in vitro с помощью Cas13a
- Активация гена в
- Оценка блокирования нецелевого расщепления in vitro
- кРНК в TXTL
- Культура клеток млекопитающих и трансфекция
- Секвенирование подготовки библиотеки малых РНК и анализ данных
- Секвенирование следующего поколения и анализ данных
- Нозерн-блоттинг-анализ
- Трансформация плазмиды в
- Измерения флуоресценции в
- Измерения флуоресценции в дрожжах
- РНК-зондирование в TXTL
- Блокирование расщепления вне мишени в TXTL
- Сводка отчетов
- Управление ориентацией золотых наностержней внутри плотноупакованных двумерных массивов
- Мультиплексная попарная сборка олигонуклеотидов ДНК, полученных из массива | Исследование нуклеиновых кислот
- Противоположное действие изоформ M1 и M23
- Детерминанты сборки аквапорина-4 в ортогональных массивах, выявленные с помощью флуоресцентной визуализации одиночных молекул живых клеток
- Страница не найдена
Сборка мебели своими руками подробная инструкция
Сборка шкафов, кроватей тумбочек при наличии необходимых навыков – простая и понятная задача. Если же процесс предстоит впервые, нужно обязательно следовать пошаговой инструкции, предлагаемой производителем.
Каждый предмет мебели собирается по определенному плану.
Нюансы работы с отдельными предметами:
- комод – наиболее прост в монтаже. Особенность – минимальное количество крепежных элементов. Самый сложный процесс – крепление направляющих на боковых панелях.
Для сборки: в несквозные отверстия заливается специальный мебельный клей и вставляются шканты. Днище, боковины и задняя стенка соединяются между собой, вставляются конфирматы. Для фиксации верхней крышки потребуются шканты и минификсы. В горизонтальную поверхность вставляются штифты, в боковины – эксцентрики. Конфирматы закручиваются до упора. В финале собираются ящики, если их поставляют в виде набора деталей, и прикручиваются ручки.
Важно: на каждом этапе проверяются диагонали, чтобы избежать перекосов;
- кровать стандартной конструкции.
Изначально после проверки комплектности собирается основа-рама из деревянных брусьев. Крепеж – конфирматы или саморезы. Далее вставляется и крепится поперечный средний брус, планки, удерживающие матрас, размещаются в пазах. Для крепления боковых стенок кровати используются нагели и заглушки.
Далее в подготовленной основе размещается матрас, устанавливаются ножки (при наличии). Важно: принцип сборки односпальной и двуспальной кровати одинаков. Разница – в размерах;
- ситуация усложняется при наличии подъемного механизма. Сначала соединяются цаги и детали изголовья. Крепеж – кронштейны, уголки, стяжки, винты. Ящики размещаются в верхней части цаг. Для крепления подъемного механизма потребуются гайки со стопором. На последнем этапе привинчиваются ручки и механизмы, ограничивающие опускание матраса;
- стандартный книжный или платяной шкаф. Изначально верхние крышки с применением конфирматов (евровинтов) крепятся к боковым панелям. Те – к днищу. Далее прибивается задняя стенка с учетом геометрии.
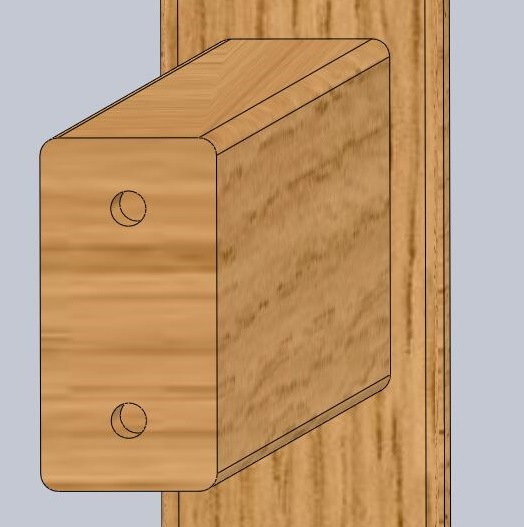 Мебельные гвозди можно заменить специальными скобами. В последнюю очередь навешивается и регулируется фасад, устанавливаются выдвижные полки и ящики. Направляющие крепятся заранее;
Мебельные гвозди можно заменить специальными скобами. В последнюю очередь навешивается и регулируется фасад, устанавливаются выдвижные полки и ящики. Направляющие крепятся заранее; - раздвижной шкаф-купе. В простейшем варианте клиент получает набор полок и двери. Боковые, задние стенки, полоток и цоколь отсутствуют. Основная задача – предварительная подготовка горизонтальных и вертикальных поверхностей. Они должны быть идеально ровными, чтобы избежать перекосов. Полки крепятся к стенам, направляющие для дверей – к полу и потолку. Нижняя рельса прикручивается после установки дверей. На первом этапе монтируются стопоры, ограничивающие движение. Одна створка размещается в дальних пазах, вторая – в ближних. На финальном этапе монтируются элементы декора, ручки, зеркала и т. д.;
- кухонный гарнитур. Его сборка своими руками считается наиболее сложной и трудоемкой. Сначала монтируются и устанавливаются на место нижние системы хранения. К днищу с использованием конфирматов крепят боковые стенки.
Далее монтируются планки, удерживающие столешницу, и заднюю стенку из ДСП. На последнем шаге устанавливаются петли для дверей, навешиваются и регулируются фасады. Направляющие для выдвижных ящиков крепятся до начала общей сборки кухонного гарнитура. Столешница устанавливается последней после тщательной проверки вертикалей и диагоналей.
Отличие верхних секций – отсутствие выдвижных ящиков, но более сложное крепление к стене. Потребуются анкеры или дюбеля-бабочки. Оптимальное расстояние от столешницы – 550-600 мм. Его увеличивают или уменьшают в зависимости от роста членов семьи.
Важно: если гарнитур угловой, первым монтируется средний шкаф. Особое внимание уделяется сборке мебели из ДСП, МДФ или ЛДСП. Из-за особенностей внутренней структуры материал может крошиться при прорезывании отверстий, установке ручек или крепежных деталей.
Необходимые инструменты
Мебельный крепеж разновидности, плюсы и минусы каждого типа
Чтобы качественно собрать и установить элементы интерьера применяется мебельный крепеж. В зависимости от места фиксации и способа соединения, существует несколько разновидностей. Данные элементы позволяют не только облегчить процедуру сборки и установки, но и будут незаметными после завершения процесса.
В зависимости от места фиксации и способа соединения, существует несколько разновидностей. Данные элементы позволяют не только облегчить процедуру сборки и установки, но и будут незаметными после завершения процесса.
Конструкция и вид крепежа будет зависеть от предназначения мебели, на которой он фиксируется. Элементы могут скреплять изделие внутри, создавая его каркас, а также крепить основание мебели к стене или полу. Сегодня применяют такие виды крепежа:
- Мебельный уголок;
- Конфирмат;
- Шкант;
- Стяжки;
- Полкодержатели;
- Болт-гайка.
Каждый из указанных видов обладает своими характеристиками и особенностями, отличающими их друг от друга. Чтобы узнать, какой элемент необходим для сборки мебели, рекомендуется подробно рассмотреть достоинства и недостатки каждой категории.
Такой элемент относится к простому и устаревшему типу крепежа для мебели. Казалось бы, если деталь устарела, то зачем о ней рассказывать? Все просто – такой уголок пригодится для начинающих сборщиков. Он также станет помощником в самостоятельном проектировании мебельных изделий и последующей сборке. К тому же, для его монтажа не требуется никакого специального оборудования или навыков. Согласно материалу производства выделяют 2 типа мебельных уголков:
Он также станет помощником в самостоятельном проектировании мебельных изделий и последующей сборке. К тому же, для его монтажа не требуется никакого специального оборудования или навыков. Согласно материалу производства выделяют 2 типа мебельных уголков:
- Пластмассовый – крепится с помощью саморезов, имеет более миниатюрный вид и сравнительно легкий вес. Такой уголок удобно использовать для стяжки легких мебельных щитов или для поддержки мебельных деталей;
- Металлический – имеет ребра жесткости и выпускается под углом 90 градусов. Чтобы зафиксировать деталь, применяют пластмассовые или металлические винты и муфты. На одной стороне уголка расположены отверстия, на противоположном – пазы.
Такие крепежные элементы используют для стяжки крыши или дна шкафа купе с его стенками или при сборке корпусной кухонной мебели. Пластмассовые варианты оснащены специальной заглушкой, которая придает изделию законченный вид.
 Из минусов крепления можно выделить постепенное расшатывание поверхностей, закрепленных с помощью уголков, а также непривлекательный внешний вид.
Из минусов крепления можно выделить постепенное расшатывание поверхностей, закрепленных с помощью уголков, а также непривлекательный внешний вид.Пластмассовый
Металлический
КонфирматТаким названием принято именовать обычные шурупы для мебели. По-другому их называют еврошурупами, а также евровинтами. Крепеж легок в установке и не требует точности, для его фиксации необходим шуруповерт или дрель. В шляпке шурупа расположено отверстие под шестигранный ключ, который также необходим для работы.
Чтобы установить данную деталь, необходимо просверлить два отверстия: одно в торце детали, а другое в элементе, который будет прикрепляться. Простота сборки мебели с помощью конфирмата позволяет мебельщику уже на месте производить сверление отверстий. Для завершения работы требуется минимум времени. Можно максимально упростить процесс, если для монтажа использовать специальное сверло для конфирмата. Однако многие мебельщики утверждают, что со временем данное приспособление расшатывается, а фрезы забиваются деревянной стружкой.
Самым популярным и используемым конфирматом считается размер 7х50 мм. Ниже представлены плюсы и минусы применения данного крепежа.
| Достоинства | Недостатки |
| Простая установка, не требующая специального оборудования. | Шляпку конфирмата будет видно, если ее не закрыть заглушкой в цвет мебели. |
| Крепеж обеспечивает отличную стяжку деталей между собой. | Крепеж нарезает резьбу в материале ДСП и может его деформировать. |
| Способен выдержать повышенные нагрузки. | Мебель, скрепленную с помощью конфирмата, нельзя собрать и разобрать более 3 раз. |
| При желании деталь можно поправить, используя киянку. |
Исходя из указанной информации, стоит отметить, что данные мебельные крепления удобные и надежные. Но если можно ими воспользоваться, то лучше отдать предпочтение эксцентриковой стяжке.
Скрытые виды крепления – это особенность мебели, собранной с помощью шкантов. Это небольшой деревянный цилиндр, его размеры часто равны 35х8 мм. Первая цифра показывает высоту элемента, а вторая говорит о диаметре крепежа. Суть крепления с помощью шкантов состоит в следующем:
- В каждой из двух деталей просверливаются отверстия;
- Отверстия должны быть соосными – то есть совпадать в местоположении оси;
- В одно отверстие вставляется шкант, который заходит вглубь лишь наполовину;
- На выступающий из мебельной детали шкан, насаживается вторая мебельная деталь – так происходит их стяжка.
Чтобы соединение обладало повышенной прочностью, в отверстие обрабатывают клеем ПВА, который дополнительно фиксирует шканты и делает их неподвижными. Большой плюс данного вида мебельного крепежа в том, что он остается невидимым: его нельзя заметить снаружи или изнутри. Шкантовое соединение обладает некоторыми недостатками: оно делается один раз, поэтому разобрать такую мебель без повреждения крайне сложно.
СтяжкиПриспособления для установки шкантов называются кондуктора. Они бывают заводскими или самодельными. Первые считаются лучшими по качеству, однако вторые можно изготовить самостоятельно.
На сегодняшний день существует две основные разновидности мебельной стяжки – эксцентриковая и межсекционная. Необходимо рассмотреть подробнее каждый из указанных типов отдельно:
- Эксцентриковая стяжка – данный элемент применяется только в условиях заводской сборки мебели. Чтобы его посадить на мебельный щит необходимо воспользоваться устройством для просверливания точного отверстия. Главный плюс такого крепежа – возможность остаться невидимым, тогда мебель приобретает аккуратный и привлекательный внешний вид. Еще одно преимущество, по сравнению с конфирматами – такие мебельные крепежи позволяют несколько раз собирать и разбирать мебель без потери жесткости.

- Межсекционная стяжка – представлена винтом и гайкой, с помощью которых стягиваются два перпендикулярных мебельных элемента. Межсекционной стяжкой удобно фиксировать изголовье и дно кровати, а также столешницы. Выбирать крепеж необходимо, исходя из размеров толщины древесностружечной плиты.
Наиболее популярный размер стяжек 32 мм, но данный показатель может достигать 50 мм.
Эксцентриковая
Межсекционная
ПолкодержателиБольшое количество полкодержателей позволяет разделить их на 2 подгруппы: для деталей из ДСП и стекла. В мебельных салонах можно обнаружить множество моделей, где стекло гармонично сочетается с деревянной основой. Чтобы качественно стянуть два разных по составу материала, используются полкодержатели.
Каждый из видов можно отдельно поделить еще на две категории: с наличием фиксации и без нее. Рассмотрим подробнее, как крепить стекло в мебели, а также, как использовать полкодержатель для ДСП.
| Полкодержатель для стекла | Полкодержатель для ДСП | |
| Конструкция | Стержень и винт. | Держатель и саморез. |
| Установка | Прикручиваются винтами к стене шкафа, в основу вкладывается полка. | Саморез крепится в стеку шкафа, а сам полкодержатель фиксирует плоскость полки. |
| Плюсы | Выглядит привлекательно, устойчиво держит полку. | Надежная фиксация полки, благодаря резьбе в материале. |
| Минусы | Требуется эластичная прокладка для предотвращения расшатывания полки. | Отверстие в полке и стене должны идеально совпадать. |
При установке полок в тумбу или шкаф без полкодержателей не обойтись. Они должны идеально подходить под стилистику мебели, сочетаться с общими принципами интерьера.
Болт-гайкаРаньше для фиксации мебельных деталей повсеместно применялась система болт-гайка.
Плюсами такого крепежа являются:
- Возможность самостоятельной сборки;
- Доступность деталей;
- Возможность многоразовой сборки и разборки мебели.
Типы, в зависимости от материала, к которому крепитсяСреди минусов можно выделить заметность креплений, именно поэтому они перестали быть актуальными. Еще один существенный недостаток – возможность соединения только параллельно стоящих поверхностей.
Современные производители сегодня используют не только ДСП для изготовления мебели. Широко применяется стекло, металлические детали, а также элементы из пластика. Крепления для мебели из ДСП были рассмотрены на протяжении всего материала, а варианты для стяжки предметов из другого сырья рассмотрены ниже:
Широко применяется стекло, металлические детали, а также элементы из пластика. Крепления для мебели из ДСП были рассмотрены на протяжении всего материала, а варианты для стяжки предметов из другого сырья рассмотрены ниже:
- Стекло – используются держатели по типу самореза, которые вкручиваются в стену из бетона или гипсокартона. С их помощью фиксируют полки и зеркальные поверхности, не повреждая покрытие детали. Для стеклянных дверей на тумбу подходит использование мебельных петель;
- Металл – для соединения полок металлических стеллажей применяются винтовые крепления. Они вкручиваются в стойки с помощью дрели или шуруповерта. С лицевой стороны устанавливается привлекательная заглушка;
- Пластик – пластмассовые детали можно зафиксировать с помощью любого крепежа для ДСП.
Отдельно стоит выделить крепление ласточкин хвост – оно применяется для соединения ящиков. Суть соединения состоит в вырезании на каждой детали гребенчатой поверхности, которая вставляется в другую деталь, в итоге получается фиксация встык. Выбирайте только тот тип крепления, который подходит наиболее оптимально. Перед покупкой обязательно вычислите толщину материала, чтобы в процессе сборки винты и саморезы не выступали на поверхности.
Выбирайте только тот тип крепления, который подходит наиболее оптимально. Перед покупкой обязательно вычислите толщину материала, чтобы в процессе сборки винты и саморезы не выступали на поверхности.
Для пластика
Для стекла
Для металла
Видео
Какая понадобится фурнитура для сборки шкафов, обзор
Прежде чем делать корпусную мебель своими руками, нужно оценить все расходы по изготовлению, сопоставив со стоимостью готового изделия. Помимо материалов, понадобится фурнитура для сборки шкафа, корпуса и фасадов. Большинство позиций крепежных метиз и комплектующих хорошо знакомы обычному домашнему мастеру.
Разновидности фурнитуры
Различают три вида мебельной фурнитуры:
- Конструкционная. Предназначена для сборки корпуса и фасадов. Сюда можно отнести весь соединительный крепеж и петли, соединяющие двери шкафа с корпусом.
- Функциональная. Используется для внутреннего наполнения шкафов. Тут все зависит от назначения. Для кухонной мебели, например, это сушки, бутылочницы, различные корзины. Для гардеробной – штанги для одежды, пантографы, брючницы и т.д.
- Лицевая. Это ручки, различные декоративные уголки, накладки и аксессуары для оформления фасадной части мебели в соответствии с выбранным дизайном.
Более обширный перечень фурнитуры будет для сборки шкафов-купе, ведь в него войдут и комплекты раздвижных систем. Дешевле всего обойдется простой шкаф с полками.
Конструкционная фурнитура: крепеж для корпуса шкафов
Практически вся корпусная мебель из ламинированного ДСП собирается на конфирматы (евровинты). За редким исключением, когда требуется скрытый крепеж – тогда используют эксцентрики различных видов или, «по старинке», шканты. Незаменимы для крепления полок в шкафах, если хочется обойти необходимость сквозного крепежа и оставить боковины без отверстий. Эксцентриковую стяжку чаще всего можно встретить в креплении столешниц офисной мебели.
За редким исключением, когда требуется скрытый крепеж – тогда используют эксцентрики различных видов или, «по старинке», шканты. Незаменимы для крепления полок в шкафах, если хочется обойти необходимость сквозного крепежа и оставить боковины без отверстий. Эксцентриковую стяжку чаще всего можно встретить в креплении столешниц офисной мебели.
С корпусной мебелью из фанеры и массива есть вариант сборки на саморезы. Волокнистая структура этих материалов позволяет даже разборку и последующую сборку на этом виде крепежа. А вот ЛДСП будет крошиться – поэтому лучше собирать шкаф на евровинты.
Задние стенки из ДВП также крепят на саморезы. Иногда используют мелкие гвозди. Их лучше дополнять небольшими шайбочками, чтобы увеличить площадь «шляпки» для большего прижима задника к торцам корпуса. Шайбы также используют при креплении ручек: если винт ручки длинный, шайба исполняет роль «прокладки».
Евровинты (конфирматы) различают по головке и длине. Головка может быть рассчитана под шестигранную или крестовую отвертку. Самая ходовая длина конфирмата – 7х50. Реже используется 5х50. Длина 7х70 пригодна для сборки утолщенного корпуса, например, из ЛДСП 22 мм. Головка может быть рассчитана под шестигранную или крестовую отвертку. Самая ходовая длина конфирмата – 7х50. Реже используется 5х50. Длина 7х70 пригодна для сборки утолщенного корпуса, например, из ЛДСП 22 мм. | |
| Эксцентрики (минификсы) состоят из трех частей – самого эксцентрика, стойки и футорки. Различают их по диаметру, длине, типу крепления и назначению. Есть эксцентрики с удобной защелкой. Как крепеж, эксцентриковая стяжка весьма трудоемка, требует определенных навыков в установке. | |
| Шканты также относят к скрытому крепежу, но более простому в установке. Современные мебельные шканты изготавливают из пластика и металла. Но пользуются популярностью по-прежнему деревянные шканты с рифленой поверхностью для лучшего сцепления. | |
| Саморезы (шурупы) 3-4×16 – основной вид мебельного крепежа после конфирматов. С помощью саморезов 4х16 и 3х16 прикручивают петли и направляющие, ножки и подпятники, уголки и выдвижные механизмы. | |
| Саморезы (шурупы) 4х30 нужны для крепления постформинга к планкам на кухне, а также для сборки шкафов из фанеры. |
Вспомогательный крепеж и фурнитура для шкафов
- Гвозди мелкие обычно заменяют шурупами. Но в бюджетной мебели, где цель минимизировать расходы, очень часто гвозди используют для крепления ДВП к ЛДСП (днищ ящиков, задних стенок).
- Уголки мебельные, пластмассовые или металлические. Или металлические с пластиковой крышкой. Используются для крепления полок, особенно часто во встроенных и частично встроенных шкафах и гардеробных. К уголкам можно отнести полкодержатели консольного вида, поскольку они имеют схожую форму.
- Полкодержатели, используются для установки съемных полок в шкафах. Самые простые и распространенные имеют вид металлического «бочонка» с диаметром 5 мм. Для стеклянных полок ассортимент полкодержателей намного больше.
 Есть варианты с фиксацией, с различными силиконовыми подложками и присосками.
Есть варианты с фиксацией, с различными силиконовыми подложками и присосками. - Подпятники, простые и регулируемые. Служат своеобразной прокладкой между полом и боковинами шкафа. С помощью регулируемых подпятников можно нивелировать кривизну пола и выставить шкаф по горизонтальному уровню.
- Ножки и колесные опоры. Для кухонных шкафов-тумб используются стандартные регулируемые ножки из пластика высотой 100-130 мм. Они могут прикрываться съемным цоколем. Или комбинироваться с декоративными металлическими ножками различных форм, если цоколь устанавливать не планируется. Для офисных шкафов часто используют ножки-«стаканы» высотой 30-50 мм. Колесные опоры придают мобильность мебели.
Конструкционная фурнитура: комплектующие для дверей шкафа
В зависимости от способа открывания створок шкафа, подбирается соответствующая фурнитура.
Распашные створки
Производители мебельной фурнитуры предлагают широчайший выбор петель, позволяющий решить практически любую поставленную задачу для распашных створок.
| Стандартные решения. Для накладных, вкладных, угловых фасадов и дверей «гармошкой» из ЛДСП, МДФ, массива и фанеры толщиной от 16 мм используют четырехшарнирные петли различных видов. Более подробно о разновидностях мебельных петель можно почитать здесь. | |
| Нестандартные решения. Для дверей из стекла, алюминиевой рамки различной ширины используются специальные петли. Так же есть варианты петель с установкой в торец (для откидных дверей, служащих столиком), со встроенным пружинным механизмом (если газлифт невозможно установить), без сверления чаши (бесчашные петли незаменимы при малой толщине фасада). | |
С дополнительными опциями. Распашные двери можно оснастить доводчиками, демпферами или петлями, уже со встроенным механизмом плавного закрывания. А также дополнить подъемными механизмами и электроприводами различного плана. В эту же группу можно отнести петли для дверей без ручек, которые будут открываться от нажатия. | |
| Определенной стилистики. Специфичного вида петли – рояльные, ломберные, пяточковые, штырьевые и т.д. Сама их конструкция не предполагает возможность регулировки фасада. Они лишь помогут подчеркнуть особенный дизайн мебели. |
Раздвижные двери купе
Любая раздвижная система купе состоит из трех частей:
- Трека (верхней и нижней направляющей).
- Комплекта роликов.
- Полотна двери.
Сама створка (полотно двери) может быть обрамлена профилями в виде каркаса. Либо комплектоваться боковыми ручками профилями по желанию.
Дверь-купе может складываться «гармошкой». В этом случае она состоит из нескольких полотен, соединенных между собой специальными петлями.
В каркасных раздвижных системах полотно двери-купе может быть наборным, в комбинации со стеклом, зеркалами и другими материалами. В этом случае используются специальные делители и уплотнитель.
Функциональная фурнитура для внутреннего наполнения шкафов
Основное наполнение шкафов – это полки. Чаще всего они изготовлены из того же материала, что и корпус. Могут крепиться жестко, быть съемными или выдвижными.
Чаще всего они изготовлены из того же материала, что и корпус. Могут крепиться жестко, быть съемными или выдвижными.
В сервантах, кухонных шкафах и витринах устанавливают стеклянные полки. А в шкафах-купе и гардеробных нередко можно увидеть сетчатые полки.
Выдвижные ящики
Вторым значимым элементом шкафа после полок можно назвать выдвижной ящик. Он может устанавливаться с помощью различных направляющих.
| Роликовые направляющие. Самый дешевый вид из всех представленных на рынке. | |
| Шариковые (телескопические). Могут быть полного и неполного выдвижения, со встроенным доводчиком в зависимости от конструкции. | |
| Металбоксы (метабоксы). Обладают лучшей несущей способностью, поскольку предполагают установку дна из ДСП. | |
Системы выдвижения с доводчиками и толкателями. Самый дорогостоящий вид направляющих сложной конструкции. |
Наполнение кухонных шкафов
Всевозможные бутылочницы, выдвижные сетки, сушки, карусели, волшебные уголки, встроенные ведра, контейнеры, емкости и аксессуары позволяют оптимизировать внутреннее пространство кухонных шкафов. Некоторые из предлагаемых комплектующих устанавливаются не внутри модуля шкафа кухни или ящика, а непосредственно на фасад.
Наполнение гардеробных шкафов
Что позволит хранить вещи более аккуратно и системно? Различные дополнительные приспособления в виде крючков, карманов, навесок, выдвижных ящиков со специальными делениями под размещение галстуков, ремней, ювелирных украшений и т.д. Также можно выделить в отдельную группу выдвижные брючницы, полки и корзины под обувь, сумки специфичной формы, раскладываемые из ниш гладильные доски, поворотные зеркала и другие механизмы.
В отдельную группу можно выделить приспособления для размещения одежды на плечиках. В первую очередь, это система Джокер: металлическая труба круглого сечения с диаметром 25 мм, которую можно укомплектовать фланцами, различными держателями и переходниками. Для неглубоких шкафов используют выдвижные поперечные штанги. К премиум сегменту можно отнести пантографы.
Для неглубоких шкафов используют выдвижные поперечные штанги. К премиум сегменту можно отнести пантографы.
Для объемных шкафов-купе и гардеробных комнат предлагаются целые системы хранения – Эльфа, Аристо, Альгот, Стольман и другие. Главное расположить их согласно правильному расчету ширины раздвижных купе, чтобы внутреннее наполнение было функциональным и удобным.
Саморезы для сборки мебели: преимущества и недостатки
Для изготовления предметов обстановки применяются различные элементы соединения деталей. Саморезы – популярный вид крепежа, имеющий свои неоспоримые достоинства. Особенно часто они используются для сборки корпусной мебели, обеспечивая добротное и долговечное соединение частей конструкции.
Саморезы – популярный вид крепежа, имеющий свои неоспоримые достоинства.
Рекомендуется проконсультироваться у продавца, если вы собираетесь создавать мебель самостоятельно.
Саморезы имеют видовые отличия. Крепежные элементы важно подбирать исходя из материала и его плотности, толщины и т. д. Также на подбор саморезов влияет тип конструкции и желаемый внешний вид изделия.
д. Также на подбор саморезов влияет тип конструкции и желаемый внешний вид изделия.
Саморезы имеют видовые отличия.
Что такое саморез?
Такой вид крепежа, как саморез, представляет собой разновидность металлического шурупа с винтовой нарезкой и заострением либо плоским концом. На шляпке элемента имеется насечка (прямая, крестовая или многоугольная) для закручивания его в полотно. Для более быстрого соединения частей шкафа или другого предмета для элементов с острым концом используется шуруповерт (за неимением – отвертка).
Также на подбор саморезов влияет тип конструкции и желаемый внешний вид изделия.
Для соединения конкретных деталей применяются элементы с разным покрытием.
Саморезы применяются для крепления деталей без подготовленных отверстий либо с ними. За счет резьбы шуруп легко вкручивается в деревянную панель или ЛДСП. Для скрытого крепления частей мебели применятся эксцентриковая стяжка, в которой саморезы играют основную роль. В результате сборки такого типа столы или другие предметы получаются аккуратными, без наружных следов монтажа, портящих внешний вид изделия.
Такой вид крепежа, как саморез, представляет собой разновидность металлического шурупа с винтовой нарезкой и заострением либо плоским концом.
Важно! Длина саморезов может доходить до 50 мм и выше. Такие крепления предназначаются для толстых панелей из цельного дерева.
Саморезы применяются для крепления деталей без подготовленных отверстий либо с ними.
На внешний вид изделия влияет возможность установки скрытого соединения.
Виды саморезов
В зависимости от материала и особенностей деталей конструкции имеются два вида креплений:
- с редкой резьбой и острым концом;
- конфирматы.
За счет резьбы шуруп легко вкручивается в деревянную панель или ЛДСП.
Первый вид используется для цельнодеревянного полотна, ДСП, ЛДСП и МДФ. Может различаться по длине и диаметру.
Для сборки нешироких полотен и фанеры используются короткие шурупы.
Конфирматы чаще имеют плоское окончание и требуют поэтому подготовленных отверстий.
К сведению. Для сборки нешироких полотен и фанеры используются короткие шурупы.
Длина саморезов может доходить до 50 мм и выше.
Второй применяется для изготовления мебели преимущественно из деревянных досок достаточной ширины. Отличается тем, что в месте соединения резьбы и гладкой верхней части на нем начинается утолщение. Конфирматы чаще имеют плоское окончание и требуют поэтому подготовленных отверстий.
Конфирматы чаще имеют плоское окончание и требуют поэтому подготовленных отверстий.
Такие крепления предназначаются для толстых панелей из цельного дерева.
Преимущества и недостатки
Для компоновки мебели крепления имеют важнейшее значение. А на внешний вид изделия влияет возможность установки скрытого соединения.
Для компоновки мебели крепления имеют важнейшее значение.
Преимуществами саморезов в качестве креплений являются:
- эксцентриковая стяжка;
- аккуратное и надежное соединение;
- точность в подгонке деталей.

При покупке саморезов важно учитывать множество моментов.
Особенно часто они используются для сборки корпусной мебели, обеспечивая добротное и долговечное соединение частей конструкции.
Если для сборки мебельной конструкции используется комплект саморезов, то при неаккуратной работе с ними возможны:
- перекосы деталей;
- ослабление крепления при неоднократном вкручивании.
Основа шурупов – сталь.
Как правильно выбрать?
При покупке саморезов важно учитывать множество моментов. Основа шурупов – сталь. Для соединения конкретных деталей применяются элементы с разным покрытием. При сборке мебели необходимо учитывать:
- длину крепежных элементов;
- их диаметр;
- толщину шляпки;
- резьбу;
- степень коррозийности (зависит от покрытия).
| Ширина и высота резьбы | Применение |
| Редкая и высокая | МДФ, дерево, ДСП, ДВП |
| Частая и низкая | Твердые породы дерева |
| Комбинированная (двухзаходная) | Комбинированные материалы (с разной плотностью) |
Для соединения конкретных деталей применяются элементы с разным покрытием.
Также на подбор саморезов влияет тип конструкции и желаемый внешний вид изделия.
Цвет креплений также важен при открытом соединении. В этом случае стоит подобрать элементы в тон полотну.
Цвет креплений также важен при открытом соединении.
Для изготовления стола или шкафа могут понадобиться разные саморезы, поэтому рекомендуется проконсультироваться у продавца, если вы собираетесь создавать мебель самостоятельно.
Стоит подобрать элементы в тон полотну.
Саморезы имеют видовые отличия.
Конфирмат используется для более надежной стяжки. При этом на шляпку часто делают заглушку, чтобы крепеж выглядел более эстетично.
Для изготовления стола или шкафа могут понадобиться разные саморезы.
Саморезы применяются для крепления деталей без подготовленных отверстий либо с ними.
ВИДЕО: Мебельные саморезы
Краткий обзор наиболее популярных материалов, используемых для изготовления мебелиУют, порядок плотно вошли в нашу жизнь. Мы привыкли спать на комфортных кроватях, обедать за столом, хранить одежду в вместительном шкафу. Для изготовления всех этих предметов используются специальные…
Мы привыкли спать на комфортных кроватях, обедать за столом, хранить одежду в вместительном шкафу. Для изготовления всех этих предметов используются специальные…
Кухонная мебель наиболее часто подвергается различным загрязнениям — в течение дня там производят множество действий: обработка продуктов, приготовление различных блюд, мытье посуды и влажная уборка. Самой…
Делаем декупаж шкафа своими рукамиВдохнуть новую жизнь в старый шкаф своими руками, сделать мебель, которая органично «впишется» в интерьер можно с помощью техники декорирования декупаж. Принцип декупажа – приклеивание бумажных…
Пошаговый МК для новичков по декупажу винных бутылок салфеткамиБесспорно, декупаж относится к наиболее популярным и простым приемам красивого и необычного оформления предметов интерьера. Декупаж не требует особенных знаний и материалов, любая рукодельница может познакомиться. ..
..
Организация кухонной зоны является одним из главных вопросов для каждой хозяйки. При минимальных размерах площади размещение кухонной утвари может стать настоящей проблемой. К одному из основных требований…
Из чего делают мебель?Материалы, из которых изготавливается мебель, довольно разнообразны. Долгое время изделия производились исключительно из натурального дерева. Чем древесина прочнее, тем сложнее ее обрабатывать, однако…
Саморезы для сборки мебели: преимущества и недостатки
Евгений · 22.09.2019
Производство долговечной корпусной мебели во многом зависит от использования качественного материала и фурнитуры. Крепежными элементами могут выступать гвозди, шурупы и саморезы. Профессионалы предпочитают использовать конфирматы мебельные, которые обладают рядом достоинств и конструктивных особенностей. Впервые такой крепеж был выпущен известной немецкой компанией Confirmat.
Особенности
Специалисты в России активно используют мебельные конфирматы с начала 90-х годов прошлого века. Их иначе именуют шурупной стяжкой, евровинтом и еврошурупом. Главным достоинством конфирматов является точность посадки и легкость установки. Для сборки мебельщику понадобится минимальное количество инструментов: дрель и четырех- или шестигранный ключ.
Тело шурупа изготавливают из металла высокого качества с антикоррозионным покрытием. Долговечность и стойкость евровинта напрямую зависит от сплава.
Высококачественная углеродистая сталь не дает стяжке возможности ломаться в ходе процесса скручивания и позволяет выдерживать любые нагрузки на изгиб. Еврошуруп обладает потайной, удлиненной головкой, а самонарезающей резьбе присущ широкий шаг.
Окончание евровинта тупое, что является отличительной чертой этого элемента по сравнению с иными разновидностями крепежа — саморезами, шурупами.
Выделяют 2 вида шлицев:
- для отвертки фигурного типа;
- для ключа с шестью гранями.

Конфирматы используют для соединения отдельных мебельных частей, изготовленных как из натурального дерева, так и из ДСП и МДФ.
Преимущества и недостатки
Создание евровинтов позволило сократить время сборки мебели. Они образуют надежное и качественное сцепление. Но мебельный конфирмат, как и все остальные виды креплений, обладает и недостатками.
Плюсы:
- образование плотной стяжки различных частей мебели;
- легкость монтажных работ;
- получение качественного сцепления;
- возможность установки с помощью киянки;
- обеспечение долговечности и стойкости конструкции.
Минусы:
- нет возможности совершать сборку и разборку мебели более трех раз без ее повреждения;
- нарезание резьбы еврошурупом внутри детали приводит к ее деформации;
- крепление не является скрытым, что влечет за собой необходимость применения дополнительных заглушек.
Изучив преимущества и недостатки фурнитуры, можно сделать вывод, что конфирматы – довольно простая и надежная стяжка, которую не рекомендуется применять для мебели, подвергающейся постоянной сборке и разборке.
Части конфирмата
Виды
Современный рынок крепежа предлагает мебельщику широкий ассортимент товаров. Перед проведением сборки необходимо определиться с видом евровинта – каждый обладает определенными качествами и подходит только для конкретных деталей.
Разновидности фурнитуры:
- со шляпкой полукруглой формы;
- с головкой потайного типа;
- со шлицом, имеющим 4 грани;
- со шлицом, имеющим 6 граней.
Соотношение наружного диаметра и общего размера стяжки приводит к выпуску крепежа стандартных типоразмеров. Размеры конфирматов и их главные характеристики приведены в таблице:
| L, длина, мм | 38,5-40 | 48,5-50 | 35,5-40 | 48,5-50 | 58,5-60 | 68,5-70 |
| P, шаг резьбы, мм | 2,4 | 2,4 | 3 | 3 | 3 | 3 |
| M, размер под ключ, мм | 3,02-3,1 | 3,02-3,1 | 4,02-4,12 | 4,02-4,12 | 4,02-4,12 | 4,02-4,12 |
| d, диаметр отверстия, мм | 2,5 | 2,5 | 3 | 3 | 3 | 3 |
| H высота головки, мм | 6 | 6 | 10 | 10 | 10 | 10 |
| D1 диаметр головки, мм | 4,92-5 | 4,92-5 | 6,92-7 | 6,92-7 | 6,92-7 | 6,92-7 |
| D2 внутренний диаметр, мм | 3,4 | 3,4 | 4,7 | 4,7 | 4,7 | 4,7 |
| D наружный диаметр, мм | 4,72-5,05 | 4,72-5,05 | 6,72-7,05 | 6,72-7,05 | 6,72-7,05 | 6,72-7,05 |
| Вес 1000 штук, кг | 4,4 | 5,49 | 7,2 | 9 | 14 | 21 |
Ходовыми среди всех типов фурнитуры считаются евровинты размером 7 х 50 и 7 х 70. Затягивают шурупы битой шестигранного типа, особым ключом или дрелью с шуруповертом.
Затягивают шурупы битой шестигранного типа, особым ключом или дрелью с шуруповертом.
Не рекомендуется применять изделия, произведенные под крестообразную отвертку. В ходе такого крепления не получится добиться качественной стяжки – через определенное время предмет мебели может сильно расшататься.
Материалы
Производители конфирматов понимают важность крепежа, поэтому изготавливают его из качественной высокоуглеродистой стали. Снаружи еврошурупы покрыты защитным слоем из цинка, никеля или латуни. Подобная структура дает эластичность.
В результате крепежная деталь прекрасно сгибается, при этом не нужно опасаться возникновения излома. Пластичность стяжке пригодится и в случае неправильного монтажа – во время извлечения шуруп сохранит свою целостность. Наибольшей популярностью пользуются еврошурупы, покрытые цинком.
Простота монтажа позволяет проводить его довольно быстро. Это радует любого специалиста – экономится время.
Перед тем как приступить к работе по соединению частей мебели конфирматами, рекомендуется разобраться в их отличиях, особенностях и качестве материала, который будет соединяться. Сцеплять друг с другом разрешается детали, созданные из следующих материалов:
Сцеплять друг с другом разрешается детали, созданные из следующих материалов:
- деревянные листы;
- ЛДСП;
- листы фанеры;
- ДСП;
- ДВП.
Для установки фурнитуры следует сверлом сделать 2 отверстия. Одно будет предназначаться для части шурупа без резьбы, а второе – для резьбовой.
При размере шурупа в 6 мм следует воспользоваться сверлом на 6 и 4 мм. Сверло меньшего размера необходимо для отверстия, предназначенного для резьбовой части.
Улучшить качество соединения можно благодаря шканту. Монтаж проводят при помощи ключа с шестью гранями.
Нюансы крепежа
Проведение даже самых простых работ по скреплению двух деталей мебели требует от исполнителя наличия особых профессиональных навыков. Отверстия под стяжку создаются сверлами, размеры которых 4 и 6 мм. Под шляпку применяют фрезу ступенчатого вида.
Специалисты советуют обратиться именно к такому варианту – он дает возможность за одно движение сделать требуемое отверстие правильного размера. Желательно применять инструменты с высокими оборотами.
Желательно применять инструменты с высокими оборотами.
Низкие приведут к образованию стружки в отверстии – сверло будет ее туда затягивать.
Рекомендуется обратить внимание на извлечение сверла – могут появиться нежелательные сколы. Они не будут критичными в случае наличия у шурупа широкой шляпки, скрывающей все недостатки работы.
Подобный крепеж обеспечит наиболее высокую степень сцепления.
При работе с конфирматами в первый раз следует все делать вручную, при возникновении высокого сопротивления винта можно легко убрать его из сцепляемых деталей мебели, не повреждая их.
Качество соединения также будет зависеть от точности намеченной на мебели разметки. К этому шагу с полной ответственностью подходят все специалисты. На части детали, располагаемой с наложением на торец другой, выполняют два вида разметки:
- глубина просверливаемого отверстия – 5-10 см;
- центральная часть отверстия должна располагаться от края на расстоянии ½ части толщины соединяемой детали.

На соединяемой детали разметку размещают на торцевой части, строго по центру мебельной плиты.
Наиболее точную разметку можно выполнить путем сверления отверстия сквозного типа в накладываемой детали. Далее, путем приложения к ней второго элемента, отмечают место отверстия, предназначенного для еврошурупа. Таким образом сборка окажется максимально ровной.
На этапе разметки для облегчения работы используется шаблон для сверления отверстий под конфирмат
Последовательность установки конфирмата
Заглушки
Для эстетичного вида собранной мебели шляпки крепежа можно скрыть заглушками. Их применяют для создания завершенного вида, они несут чисто декоративную функцию. Заглушки могут использоваться и для сокрытия небольших дефектов при сборке, особенно на лицевых, фасадных сторонах мебели.
Выделяют следующие разновидности заглушек:
- Самоклеящиеся. Используются в случае, когда необходимо скрыть шуруп с прямой головкой.
 Мастера тогда подбирают элемент декора подходящего цветового оттенка.
Мастера тогда подбирают элемент декора подходящего цветового оттенка. - Пластиковые. Устанавливаются на шурупы любого вида.
- Деревянные. Они дороже и предназначены для элитной мебели из массива дерева, могут требовать окраски под цвет.
По форме пластиковые заглушки могут быть круглыми с различным диаметром или многоугольными (чаще применяются квадратные или прямоугольные). Цветовых решений подобных элементов очень много. При их изготовлении принимаются во внимание основные варианты расцветок ЛДСП, МДФ.
Стоимость всех разновидностей пластиковых заглушек практически одинакова, в магазинах они предлагаются в упаковках по 10 штук. Могут иметь разный диаметр шляпки и подбираются по вкусу. Держатся эти элементы на шестигранном выступе, имеющемся у еврошурупа.
Очень важно, чтобы заглушка крепилась на конфирмате с некоторым усилием, тогда она будет надежно зафиксирована и не отпадет.
Самоклеящийся декор является наиболее универсальным вариантом заглушки, его создают из меламина, покрытого тонким клеевым раствором. Форма аналогична пластиковой. Достоинством такого элемента является его толщина (0,3 мм), он не выделяется на общем фоне и практически незаметен, его удобно ставить.
Форма аналогична пластиковой. Достоинством такого элемента является его толщина (0,3 мм), он не выделяется на общем фоне и практически незаметен, его удобно ставить.
Мебельные салоны предпочитают использовать именно такие детали для маскировки конфирматов. Минусом можно назвать то, что перед тем как поставить заглушку на место, предварительно нужно обезжирить поверхность, иначе со временем элемент может просто отвалиться. Предлагаются в упаковках по 50 штук.
Деревянные
Пластиковые
Самоклеющиеся
Источник: https://mebel-sovet.ru/furnitura-i-komplektuyushhie/224-konfirmaty-mebelnye
Виды мебельных соединений
Вы здесь
Для изготовления и сборки корпусной мебели применяются различные способы соединения деталей между собой. Вид мебельных креплений существенно влияет на стоимость самой мебели, а покупатель не обращает на такую деталь особого внимания. Однако необходимо отметить, что крепление влияет на качество изделия, ее срок службы, а так же ее эстетичность.
Мебельная соединительная фурнитура различается по назначению, стоимости, надежности и сложности установки.
Существует множество видов мебельной соединительной фурнитуры. Мы рассмотрим только самые распространенные соединительные элементы.
| Мебельный уголок является самым простым и недорогим способом соединения корпусной и мягкой мебели. Мебельные уголки используются разных форм, размеров, пластиковые и металлические. Они очень просты в установке. Одно из главных преимуществ мебельного уголка — это надежность. | |
Конфирмат или шурупная стяжка, одноэлементное крепление, одно из самых надежных и в то же время недорогих мебельных соединений. Устойчив к механическому воздействию и на излом. В монтаже не требует точного сверления и приспособлений. Для монтажа сверлится отверстие специальным конфирматным сверлом, имеющим три диаметра, однако можно сверлить и тремя обычными сверлами разных диаметров. Применяется как для деревянных конструкций, так и для ДСП. Недостаток — риск порчи резьбы при многократной разборке и сборке мебели, требует сквозного сверления деталей, что нарушает их целостность, шляпка будет видна. Может заглушаться для эстетики заглушкой. Применяется как для деревянных конструкций, так и для ДСП. Недостаток — риск порчи резьбы при многократной разборке и сборке мебели, требует сквозного сверления деталей, что нарушает их целостность, шляпка будет видна. Может заглушаться для эстетики заглушкой. | |
| Минификс — одно из самых распространенных мебельных соединений. Минификс предназначен для соединения мебельных деталей под прямым углом. Однако существует угловой минификс, который позволяет соединять детали под различными углами.Миниификс состоит из штока и эксцентрика. Иногда под шток используется пластиковая муфта.Недостатки: требует точного сверления, высокая цена, влияющая на стоимость мебели.Достоинства: 1. Мебель монтируется быстро с помощью одной отвертки. 2. Рассчитан на много циклов сборки и разборки мебели без вреда для мебели. 3. Скрытое крепление, что ценно для видных частей мебели, таких как фасад, боковина мебели. | |
Рафикс — эксцентриковая стяжка для соединения двух деталей мебели. Так же рафикс используется как полкодержатель. Рафикс состоит из эксцентрика в пластиковом корпусе, штока, иногда используется футурка для надежного крепления дюбеля (шток).Установка рафикса легче, чем монтаж минификса, требуется менее точная сверловка, не три отверстия, а два. Так же не требуется дублировать крепление штоком как минификсовую стяжку. Рафикс имеет пластиковый корпус, цвет которого можно подбирать под цвет ДСП мебели. Так же рафикс используется как полкодержатель. Рафикс состоит из эксцентрика в пластиковом корпусе, штока, иногда используется футурка для надежного крепления дюбеля (шток).Установка рафикса легче, чем монтаж минификса, требуется менее точная сверловка, не три отверстия, а два. Так же не требуется дублировать крепление штоком как минификсовую стяжку. Рафикс имеет пластиковый корпус, цвет которого можно подбирать под цвет ДСП мебели.Преимущества рафикса:— возможность быстро собирать и разбирать мебель без вреда для соединения, эстетичность, простота монтажа Недостатки рафикса:— высокая цена | |
Шток — деревянный стержень цилиндрической формы с фасками и закруглениями на концах. Изготавливается из твердых пород дерева или пластмассы. Фаски служат для прохода воздуха при использовании клея, а так же для лучшего сцепления. Рефления (фаски) могу иметь разный рисунок: прямой, круговой (поперечный), винтовой. Так же можно отметить, что шток встречается разной длинны и диаметра. Шток может применяться как с клеем ПВА, так и без него. При использовании клея такое крепление более надежное, но уже не разборное.Так же шток служит дополнительным, дублирующим креплением при сборке мебели на минификсах. Шток может применяться как с клеем ПВА, так и без него. При использовании клея такое крепление более надежное, но уже не разборное.Так же шток служит дополнительным, дублирующим креплением при сборке мебели на минификсах.Преимущество шканта
| |
| Используется вместо межсекционной стяжки. Для того чтобы скрыть шляпку самореза, им стягивают секции между собой в тех местах, где будет установлена монтажная планка мебельной петли или будет стоять полка.Удобство стяжки саморезами — быстрота, низкая ценаНедостаток стяжки саморезом — слабое крепление | |
| Межсекционная стяжка используется для плотного соединения секций мебели между собой. |
Виды мебельных соединений, конфермат, минификс, шток, рафикс, мебельный уголок, мебельная фурнитура, виды мебельной фурнитуры
Источник: https://mebelsborka. kiev.ua/vidi-soedineniy
kiev.ua/vidi-soedineniy
Саморезы для ДСП
17.03.2017
Саморезы для ДСП – это универсальные саморезы для соединения листов ДСП. К таким саморезам, можно отнести, ГОСТ 1144-80, ГОСТ 1145-80 и ГОСТ 1146-80, которые имеют различный диаметр от 1.6 мм до 10.0 мм, а длина может достигать 120 мм, что позволяет соединить листы различной толщины. Листы ДСП широко применяются в различных сферах производства от мебели до отделки стен в помещении, так как данный материал имеет стоимость значительно ниже, чем другие изделия из древесины и прост в установке.
Изобретение ДСП (древесно-стружечной плиты) в середине прошлого века имело чисто коммерческую подоплеку, поскольку отходы деревообрабатывающих предприятий, большей частью опилки, на то время составляли, примерно, 40%. Изготовление ДСП позволило снизить этот показатель до 10%.
В наши дни этот материал широко используется в производстве мебели, различных перегородок, при внутренней отделке помещений, как черновой, так и чистовой. Наиболее популярная толщина 16 мм. Может иметь ламинированное покрытие.
Наиболее популярная толщина 16 мм. Может иметь ламинированное покрытие.
Продается как мебельными щитами определенных размеров, так и большими листами. Как правило, крупные строительные магазины предлагают распиловку на месте за символическую плату или вовсе бесплатно. Здесь же можно приобрести все необходимые метизы для самостоятельной сборки любых конструкций.
Это, в первую очередь, саморезы. Остановимся на них подробней.
Шуруп со сверлом, шлицем типа torx и потайной головкой
Универсальные саморезы.
По стандартам ГОСТ 1144-80 , 1145-80, 1146-80 выпускаются диаметрами:
- 1.6 мм,
- 2.0 мм,
- 2.5 мм,
- 3.0 мм,
- 4.0 мм,
- 5.0 мм,
- 6.0 мм,
- 8.0 мм,
- 10.0 мм
И длиной:
- 13 мм,
- 16 мм,
- 20 мм,
- 25 мм,
- 30 мм,
- 35 мм,
- 40 мм,
- 45 мм,
- 50 мм,
- 60 мм,
- 70 мм,
- 80 мм,
- 90 мм,
- 100 мм,
- 110 мм,
- 120 мм.

Наличие сверла значительно облегчает процесс вкручивания. Рекомендуется просверлить отверстие в закрепляемой детали, поскольку резьба неполная. На внутренней стороне головки есть зенкующие ребра. Имеет следующие размеры:
- диаметр стержня 4-6 мм;
- длина 18-160 мм;
- диаметр головки 7,5-11,5 мм;
- длина сверла 3,7-6,7 мм.
Шуруп со шлицем типа torx и полукруглой головкой
- диаметр стержня 3-6 мм;
- длина 16-120 мм;
- диаметр головки 6-12 мм;
- высота головки 2,3-4,2 мм.
- Резьба полная. Рекомендуется предварительное засверливание, особенно при торцевом соединении.
Саморез со шлицем типа torx и потайной головкой
- диаметр стержня 3-6 мм;
- длина 12-100 мм;
- диаметр головки 6-12 мм;
- высота головки 1,6-3,6 мм.
- Полная резьба.
Саморез со шлицем типа torx и полупотайной головкой
- диаметр стержня 3-5 мм;
- длина 12-35 мм;
- диаметр головки 6-10 мм;
- высота головки 1,6-3 мм.

- Возможен усиленный вариант, изготовленный из стали более высокой прочности.
Саморез со шлицем типа torx, широкой полукруглой головкой и неполной резьбой
- диаметр стержня 4,8 мм;
- длина 25-60 мм;
- диаметр головки 12 мм;
- высота головки 2,5 мм.
Саморез со шлицем типа torx, широкой полукруглой головкой и полной резьбой
- диаметр стержня 6-7 мм;
- длина 20-70 мм;
- диаметр головки 13-14 мм;
- высота головки 3 мм.
Саморез со шлицем «крест» Pz, полной резьбой и полукруглой головкой
- диаметр стержня 3-6 мм;
- длина 16-200 мм;
- диаметр головки 6-12 мм;
- высота головки 2,3-4,2 мм.
Саморез со шлицем «крест» Pz, полной резьбой и полупотайной головкой
- диаметр стержня 3-5 мм;
- длина 12-100 мм;
- диаметр головки 6-10 мм;
- высота головки 1,6-3 мм.
Саморез со шлицем «крест» Pz, полной резьбой и потайной головкой
- диаметр стержня 3-6 мм;
- длина 10-200 мм;
- диаметр головки 6-12 мм;
- высота головки 1,8-3,3 мм.

Фосфатированные саморезы
В обиходе еще называют «черные саморезы». По причине низкой стоимости активно применяются при черновой отделке, например, монтаже полов. Из недостатков – подверженность коррозии и хрупкость. При нагрузке на срез использовать не рекомендуется. Имеют потайную головку и крестообразный шлиц типа Ph. Размерный диапазон: диаметр стержня 3,5-4,8 мм;
длина 16-152 мм.
Конфирмат
Он же еврошуруп или мебельная стяжка – относительно новый крепежный элемент. Оснащен плоской головкой с шестигранным углублением. Требует предварительного засверливания. Может иметь следующие размеры: диаметр стержня от 5 до 7,5 мм;
длина от 40 до 70 мм.
Для более надежного и прочного соединения рекомендуется сначала просверлить отверстие под резьбовую часть, затем неглубокое под не резьбовую и сделать зенковку под шляпку. Если вам часто приходится использовать данный вид крепежа, то есть смысл приобрести ступенчатое сверло, которое позволяет совершать все эти операции одновременно.
При наличии перечисленных метизов, вы сможете смонтировать любые возможные конструкции из ДСП, будь то короба, мебель или элементы отделки.
Почему и когда необходимо засверливание?
Казалось бы, без него саморез будет плотнее входить в ДСП, создавая оптимальное соединение, но у кажущегося плюса есть и обратная сторона – внутреннее напряжение материала. Особенно это актуально при вкручивании в узкую кромочную часть заготовки.
Стоит, так же, обратить внимание на особенность производства ДСП, когда возможно попадание довольно крупной и твердой фракции, что обязательно приведет к расслоению и даже может повредить ламинированное покрытие.
Засверливание, конечно, замедлит процесс монтажа, но, несомненно, убережет от подобных неприятностей.
В случае с фасадным соединением, велик риск повредить покрытие, испортив тем самым его внешний вид. Здесь на помощь также придет предварительное засверливание и зенковка. Скрыть место крепежа помогут заглушки, пластиковые или самоклеющиеся, подходящие по цвету.
Крепление ДСП к стене
Часто ДСП используют при отделке стен помещения как большими панелями во всю высоту, так и частично или в виде небольших декоративных деталей. Здесь очень важно учитывать плотность материала, из которого сделано основание для монтажа. Это может быть древесина, гипсокартон, кирпич или бетон.
Проще всего с деревом, подойдут практически любые саморезы или шурупы нужного размера, вплоть до универсальных, подходящие вам по цвету.
Фосфатированные саморезы лучше не использовать, так как велика вероятность надлома головки, а последующее аккуратное извлечение обломков не всегда возможно. Правильно рассчитайте нагрузку на одну точку крепления.
Иногда достаточно применения гвоздей. Например, с уместными декоративными шляпками или вовсе без таковых.
В случае с гипсокартоном следует использовать специальные дюбеля. Еще лучше, если крепеж придется на металлический профиль, хотя бы большая часть точек крепления. Найти профиль поможет мощный магнит.
ри монтаже к бетонной или кирпичной стене хорошо подходят пластиковые дюбеля. Выбор их на рынке очень велик, поэтому есть возможность выбрать оптимальный вариант. Обратите внимание, что для пористого бетона и обычного они будут различаться. Есть также разные модели для пустотелого и полнотелого кирпича.
Помните, что просверливаемое отверстие под дюбель должно строго соответствовать диаметру последнего, глубина же будет минимум на 5 мм больше. В этом случае, дюбель при деформации заполнит пустующее пространство, а не станет выпирать наружу.
Таблица для выбора самореза в зависимости от нагрузки на одну точку крепежа
| менее 1,0 | 3×25 | 3×16 | 3×16 | 3×16 | 3×25 | 3×16 |
| до 5,0 | 3×25 | 3×20 | 3×25 | 3×25 | 3×30 | 3×16 |
| до 10,0 | 4×25 | 4×20 | 4×25 | 4×30 | 3×25 | 3×16 |
| до 20,0 | 4×50 | 4×40 | 4×50 | 4×70 | 4×50 | 4×16 |
| до 30,0 | 5×70 | 5×50 | 5×70 | 5×70 | 5×50 | 4×16 |
| до 50,0 | 6×80 | 6×60 | 6×80 | 6×90 | 6×60 | — |
| до 75,0 | 8×100 | 8×80 | 8×100 | 8×140 | 8×100 | — |
| до 100,0 | 10×140 | 10×100 | 10×160 | 10×160 | 8×120 | — |
«Спрятать» места крепления можно применив различные элементы декора, такие как молдинги, раскладки или галтели. Также широко используются всевозможные варианты заглушек.
Также широко используются всевозможные варианты заглушек.
СОВЕТ!
К сожалению, соединения, в которых саморез нарезает резьбу непосредственно в ДСП, плохо переносят частый демонтаж. С каждым разом они становятся все менее надежными. В первую очередь, это связано с особенностями структуры ДСП.
Но при ремонте или переезде такая необходимость может возникнуть. Есть возможность восстановить расшатавшееся отверстие. Смешайте клей ПВА с опилками, лучше помельче, такие получаются при распиловке древесины ножовкой или циркулярной пилой.
Тщательно заполните отверстие получившимся составом. Выдержите сутки. Все, можно производить монтаж.
Инструмент для крепления изделий из ДСП
Сегодня уже мало кто при сборке мебели или отделке будет применять обычные отвертки, разве что подтянуть ослабший крепеж.
Гораздо легче и удобнее использовать ручную электрическую или аккумуляторную дрель-шуруповерт с регулируемой скоростью вращения. Разнообразие шлицев у крепежных изделий диктует свои условия.
Имеет смысл приобрести магнитную насадку на дрель и набор качественных бит к ней самых разных конфигураций. Это значительно облегчит и ускорит вашу работу.
Монтаж изделий из ДСП следует производить на небольшой скорости, достаточной для плавного нарезания резьбы.
С помощью этого же инструмента можно аккуратно сделать предварительное засверливание и зенковку. Обычной дрелью это будет затруднительно, поскольку она значительно тяжелее, да и при частом использовании на малых оборотах очень быстро изнашивается.
Будьте особо внимательны при использовании бит типа Pz и Ph. Они внешне похожи, но если их перепутать, то вы рискуете повредить как сами биты, так и саморезы.
Материалы подготовлены специалистами компании «Трайв-Комплект». При копирование текстов и других материалов сайта — указание
ссылки на сайт www. traiv-komplekt.ru обязательно!
traiv-komplekt.ru обязательно!
Источник: https://traiv-komplekt.ru/articles/samorezi-dlya-dsp/
Мебель на саморезах — Заметки о мебели
Почти вся мебель, которая продается в магазинах, собрана на конфирматах, минификсах и шкантах. Мне не приходилось видеть саморезы в качестве элементов сборки корпусной мебели для продажи. Саморезы для сборки использовать допустимо, но с рядом оговорок.
- Конфирматы значительно превосходят саморезы в циклах сборки/разборки изделия, потому что конфирмат не может сделать новое отверстие, если промазать по имеющейся дырке в ответной детали.
- Конфирматы во время закручивания стягивают детали между собой. Саморезы просто фиксируют (Будете криво/косо держать, когда закручиваете саморез, криво и зафиксируете).
Если мебель не предполагается разбирать, то саморез для домашнего использования вполне подходит. Отверстие под него не такое большое, монтировать быстрее. А вот если нужно разобрать/собрать хотя бы 2-3 раза, то уже можно задуматься об конфирмате.
Вся засада в том, что саморез легко делает себе новое отверстие. Ведь нет никакой гарантии, что второй раз при завинчивании он пойдет по той же резьбе, а не начнет нарезать новую. Чуть увел в сторону на миллиметр другой при повторной сборке и отверстие разрыхлилось.
И всё, лдсп уже не держит как в первый раз (а в третий раз тем более).
Есть такой человек, мастер на все руки, Виталий Лужецкий, который имеет youtube канал, про строительство, ремонт и отделку. Не всегда я с ним согласен, но видео познавательные. У него на канале опубликовано видео «Конфирмат или саморез», где он отстаивает свою точку зрения, что мебель можно собирать на саморезах.
ЛДСП имеет свойство со временем разрушаться. Есть мнение, что со временем — саморез быстрее вылетит, чем конфирмат. Насколько быстро придет время зависит от состава смолы ЛДСП. Мне пока с этим не доводилось сталкиваться. Мой коллега по работе собирал дома шкафы в гардеробной комнате на желтых саморезах, стоят 4 года. Проблем нет.
Проблем нет.
Свою первую мебель — кровать я собрал на саморезах.
После 3 циклов сборки-разборки саморезы разбили отверстия и с этим надо было что-то делать. Вариантов немного, однозначно надо увеличивать отверстие и ставить другое крепление. Какое? Естественно конфирматы. Рассверлил отверстия сверлом на 5 и собрал конструкцию конфирматами 7х70.
// ToDo теперь это выглядит так.
P.S. Что делать если резьба под конфирматом стерлась?
Залить смесью опилок и мебельного клея (или простого ПВА). После высыхания заново просверлить отверстие сверлом на 5мм. Должно держаться. Плюс почти вся мебель собирается на конфирматах длиной 50мм, можно поставить длиной 70 мм, их также легко купить.
Источник: https://blog-pro-mebel.ru/posts/mebel-na-samorezah
Мебельный крепеж. Виды и применение. Особенности и материал
Мебельный крепеж применяется для соединения элементов мебели. Его использование позволяет удешевить производство в сравнении с более сложными техниками фиксации типа шип-паз или ласточкин хвост.
Кроме этого применение крепежа часто позволяет отказаться от скрепления элементов мебели с помощью клея. Это делает ее разборной и облегчает транспортировку.
При покупке мебели, соединение которой обеспечивается современным крепежом, она доставляется в разобранном виде, поэтому ее легче вносить в квартиры, дома и офисы.
Какой бывает мебельный крепежК современным типам крепежа можно отнести:
- Саморез.
- Конфирмат.
- Эксцентриковая стяжка.
- Межсекционная стяжка.
- Стяжка для столешницы.
- Мебельный уголок.
- Рафикс.
- Шток.
Это бюджетный и распространенный тип крепежа, с помощью которого осуществляется присоединение двух плоскостей между собой. Также с помощью саморезов крепятся крючки, петли и некоторые виды ручек.
Саморезы стоят дешево и вкручиваются очень быстро, особенно при применении шуруповерта. Недостатком такой стяжки является слабое крепление. Саморезы подходят далеко не для всех материалов.
Саморезы подходят далеко не для всех материалов.
Их можно использовать на натуральной древесине, поскольку ее волокна надежно удерживают резьбу крепежа. В случае же с МДФ или ДСП под нагрузкой они вырываются.
При сборке мебели перед вкручиванием самореза рекомендовано сначала просверлить отверстие под его длину, но меньшего диаметра. Это исключит растрескивание дерева вдоль волокон. Данное правило является обязательным при работе с мебелью из твердых пород дерева.
КонфирматЭто специализированная шурупная стяжка, у которой имеется широкая резьба, обеспечивающая более надежное крепление, чем шуруп. Конфирмат лишь немного дороже, но он может работать с ДСП и МДФ. Перед его применением также необходимо обязательно подготовить отверстие.
Крепление подходит в том случае если мебель будет собрана и установлена на одном месте без необходимости в дальнейшем ее разбирать и перевозить. Дело в том, что если конфирмат часто выкручивать и вкручивать, то нарезанная резьба в ДСП или МДФ повреждается и шуруп больше не удерживается.
В этом случае в поврежденное отверстие вклеивается деревянный чопик. После высыхания в нем проводится новое сверление и конфирмат закручивается уже надежно. Данное крепление не совместимо с обычными крестовыми отвертками. Для него требуется шестигранный ключ, стоимость которого очень низкая.
Он всегда идет в комплекте с мебелью.
При работе с конфирматом вкручивание нужно осуществлять со всей осторожностью, поскольку если приложить чрезмерные усилия произойдет срыв резьбы.
При использовании данного крепежа его головки, утопленные в мебель, остаются видимыми, что негативно сказывается на эстетике. Для решения данной проблемы предусматриваются специальные пластиковые заглушки, которые вставляются в отверстие под шестигранный ключ.
Конечно, они не могут полностью решить проблему заметности, но с ними мебель выглядит более привлекательно.
Данный крепеж также называется минификс. Он применяется при необходимости провести соединение детали мебели под прямым углом. Прибор состоит из двух элементов: штока и эксцентрика. Стоимость такого крепежа на порядок выше, чем конфирмата или самореза.
Для его установки нужно провести точное сверление. В дальнейшем при сборке достаточно отвертки или шуруповерта. Минификс выдерживает многократную сборку и разборку без повреждения посадочных гнезд.
Эксцентриковая стяжка незаметна, поэтому ее применяют при необходимости соединения фасадных и боковых частей мебели.
Применяя такой мебельный крепеж необходимо также использовать специальное сверло Форстнера.
Частные мастера, которые занимаются изготовлением мебели, зачастую отказываются от применения эксцентриковой стяжки, поскольку она требует сложного сверления высокой точности.
На промышленных производствах имеются точные станки, исключающие погрешность, работающие по шаблону или под управлением ЧПУ, что дает возможность без проблем ставить минификс.
Такой вид крепежа предназначен специально для плотного стягивания секций мебели между собой. Она представляет собой классический винт и высокую гайку, в которую он закручивается.
На ее тыльной стороне имеется шляпка, предотвращающая сквозной проход крепежа сквозь подготовленное отверстие. С помощью стяжки можно намертво соединить между собой два шкафа, что добавит им устойчивости и исключит образование щелей.
Высота межсекционной стяжки может быть разнообразной, что зависит от толщины поверхностей, которые нужно соединить.
Такой мебельный крепеж обычно устанавливается в каждом углу мебели. Его ставят за 3-5 см от ее торцов. Чтобы провести точное сверление обычно сначала проводят фиксацию элементов между собой с помощью струбцины. После того готовится одно сквозное отверстие, в которое продевается межсекционная стяжка.
Стяжка для столешницыТакой мебельный крепеж используется для стягивания друг к другу двух частей столешницы. Чаще всего он применяется при сборке кухонной мебели. Обычно для соединения столешниц используют 2 стяжки или больше, чтобы повысить надежность.
Чаще всего он применяется при сборке кухонной мебели. Обычно для соединения столешниц используют 2 стяжки или больше, чтобы повысить надежность.
Данный крепеж состоит из длинного болта, гайки и пары прямоугольных скругленных шайб. Для соединения делается не сквозное широкое отверстие перьевым сверлом на одной и второй секции столешницы. После этого между ними прорезается канавка, и вставляется стяжка.
С помощью винта она затягивается, плотно прижимая половины столешницы.
Мебельный уголокЭто бюджетный способ соединения, с помощью которого прикрепляются 2 детали под прямым углом. Его используют только в том случае, если на мебельный крепеж будет оказываться незначительная нагрузка.
Иногда с помощью уголка фиксируют полки, но в этом случае их можно будет снять только после его отсоединения. Данный крепеж держится с помощью саморезов, что и является причиной его низкой эффективности.
Дело в том, что можно применить только короткие шурупы, что обусловлено малой толщиной деталей.
Надежность уголка зависит от его размера. Если его стороны длинные и предусматривается возможность вкручивания нескольких шурупов, то такой крепеж способен выдерживать довольно серьезные нагрузки, особенно если сделан из стали или алюминия. Для менее ответственных креплений применяются пластиковые уголки с крышкой, позволяющей закрыть шляпки саморезов.
РафиксДанный мебельный крепеж является разновидностью эксцентриковой стяжки, применяемой для соединения двух деталей мебели. Его можно использовать для закрепления полок. Такое приспособление позволяет проводить более простой монтаж, чем применяя минификс. Это обусловлено возможностью менее точного сверления.
Такое соединение допускает сборку и разборку без нанесения вреда снимаемым деталям. Сам крепеж состоит из муфты или дюбеля, который вставляется в отверстие одной детали, и шурупа для ее закрепления. К нему фиксируется пластиковый эксцентрик, установленный на второй элемент мебели.
Эксцентрик монтируется в большое отверстие, сделанное сверлом Форстнера.
Это самый дешевый и древний мебельный крепеж. Его также называют чопик и шкант. Он представляет собой небольшой деревянный стержень, сделанный в цилиндрической форме с фасками на обоих концах. Его делают из твердых пород дерева.
Иногда можно встретить изделия из пластика. По поверхности штока нанесено рифление, что необходимо для его лучшего промазывания столярным клеем. Также возможно использовать чопик без клея, но в этом случае соединение менее надежно.
Данный крепеж используется для соединения двух элементов мебели. Для этого в них сверлятся отверстия друг напротив друга, так чтобы они состыковались. После этого в них заливается небольшое количество клея и забивается шкант.
Такой способ соединения довольно надежный, но в дальнейшем не позволит провести безопасную разборку мебели в случае переезда.
Шток стоит дешево, поэтому часто применяется при сборке бюджетных шкафов и письменных столов, на которые будет оказываться небольшая нагрузка.
Лучшими считаются мебельный крепеж из стали. Они более устойчивы к нагрузкам, поэтому при их использовании сборка будет более надежной. Для их производства используется обыкновенная сталь, в связи с этим ее покрывают слоем цинка, для защиты от коррозии.
Иногда в продаже можно встретить черный крепеж, что является большой редкостью. При использовании конфирмата особых требований к цвету нет, поскольку видимые шляпки закрываются заглушками, оттенок которых уже подбирается под мебель.
Для саморезов цвет важен, поскольку они зачастую заметны, особенно при использовании для крепления дверных петель. Они бывают серебристыми, черными и золотистыми.
Гораздо реже стального крепежа используются изделия из алюминия. Их недостатком является увеличенная толщина, поскольку данный металл отличается склонностью к деформации под нагрузкой. Обычно из алюминия изготовляют уголки, а также эксцентрики для минификса и рафикса.
При производстве отдельных видов крепежа применяется пластик. В первую очередь он используется для изготовления уголков и рафикса, а именно корпуса его эксцентрика. Пластиковые элементы могут иметь различные цвета. В продаже можно встретить белые, черные, коричневые и т.д. В случае с уголками цвет действительно важен, поскольку они обычно остаются заметными.
Из дерева делают только шток. Он изготовляется из различных пород древесины, поэтому его оттенок может отличаться. Этот элемент полностью скрывается.
Похожие темы:
Источник: https://tehpribory.ru/glavnaia/materialy/mebelnyi-krepezh.html
Мебельные стяжки: Минификсы, Рафиксы, Конфирматы.
Друзья!
Переходите сразу в нужные разделы:
Каталог мебельных стяжек
Мастера считают, что красота в мебельных соединениях лишняя, во всяком случае, это тема на третьем месте после прочности соединения и способа установки. Правда, никто из профессионалов не отрицает лучший вариант, когда мебельная стяжка невидима. Получить такой крепеж можно разными способами: по старинке неразборно-клеевым методом, или с помощью механических стяжек, (эксцентриковые, угловые, стягиваемые) которые по своей сути работают, «врезаясь» в массив или ЛДСП.
Получить такой крепеж можно разными способами: по старинке неразборно-клеевым методом, или с помощью механических стяжек, (эксцентриковые, угловые, стягиваемые) которые по своей сути работают, «врезаясь» в массив или ЛДСП.
Суть любой стяжки – собрать разрозненные части мебели, не используя клей, за минимум времени с набором «домашних» инструментов. Королева мебельных стяжек – это такая стяжка, которая, помимо прочего позволит собранную мебель не только разобрать, но и соединить повторно. Обычно покупатели про это думают так, — «Мы не собираемся с переездом, нам подобные опции излишни». Тем не менее (удивительно, правда, как наши планы постоянно кто-то рихтует, мы ведь точно знали, что ничего такого не будет?) изо дня в день добротная мебель подвергается порче, либо при разборке, либо при транспортировке. В ответственный момент вы вспоминаете что, стол или шкаф на «одноразовом» крепеже, и вынуждены перемещать его в собранном состоянии, калеча при погрузке/разгрузке/доставке, ведь защитить целостный предмет мебели гораздо сложнее чем отдельную деталь. Совет простой, всегда думайте про запас, загляните к нам, посмотрите для чего в деталях делают присадку и комплектуют несъёмным крепежом и зачем вам нужно обзавестись правильными стяжками.
Совет простой, всегда думайте про запас, загляните к нам, посмотрите для чего в деталях делают присадку и комплектуют несъёмным крепежом и зачем вам нужно обзавестись правильными стяжками.
Минификс (Minifix)
Минификс (эксцентрик) полускрытый крепеж, обеспечивающий быстрый монтаж для массива и ЛДСП.
Идеально выдерживает неоднократные циклы сборка/разборка. Актуален для мебели, часто участвующей в переездах, для «событийной» мебели, которую используют кратковременно, а потом разбирают и бережно хранят до следующего раза, и т. п.
На фасаде мебели минификс невидим. Благодаря своим скрытым возможностям этот тип фурнитуры позволяет не нарушать целостность лицевого слоя. Вы обнаружите его только внутри изделия, если загляните в шкаф, под стол и т.д., а если эксцентриковая стяжка произведена Хефеле, то за мгновение она покорит вас ещё и своим изяществом, не говоря о других преимуществах. Впрочем, раз уж речь зашла о плюсах, не будем их скрывать:
1. У минификсов Хефеле реализован центрический шаровой принцип в затяжке (болт всегда перемещается равноудаленно по кругу относительно вертикальной оси), что центрует корпус и позволяет обеспечить соединение без потери жёсткости, смещений в сторону деталей, и может использоваться под любым углом (если используется соединение на ус).
2. На ход затягивания Хефеле выделил 5 мм! Любой профессионал порадуется такой опции, потому что знает, что каждый поворот корпуса менее чем на половину оборота, даст компенсацию допуска (на размер сверления) от 1 до 0,5 мм, с сохранением зажимного усилия.
3. Теперь не нужно поворачивать корпус на 195 градусов, (до упора), чтобы получить зажимное усилие, достаточно умеренного натяжения.
4. Все болты и корпусы минификс, дружат друг с другом, отсюда их взаимовыгодное комбинирование.
5. Даже если вы разобрали свою мебель несколько раз, ослабили и затянули корпус, минификсы Хефеле останутся самой надежной корпусной стяжкой из всех известных.
6. Могут стягивать детали толщиной от 12 мм.
Из минусов, можно отметить один — это щепетильность в подготовительной работе. Без присадочного оборудования, которое есть не у всех, в силу своей высокой стоимости (в Эксперт- комплекте есть, так что может этот пункт вам и не важен)установка минификсов потребует временных и технических усилий. Для ручной установки готовьтесь с высокой точностью сделать разметки для всех трех отверстий, которые к тому же находятся в разных плоскостях, не каждый мастер способен отдать этому кропотливому делу столько стараний. Малейшая оплошность и вы не сможете отрегулировать соединение.
Для ручной установки готовьтесь с высокой точностью сделать разметки для всех трех отверстий, которые к тому же находятся в разных плоскостях, не каждый мастер способен отдать этому кропотливому делу столько стараний. Малейшая оплошность и вы не сможете отрегулировать соединение.
Конфирмат
Поскольку стоимость минификсов, сегодня относится к значимой, то все мало-мальски считающие деньги покупатели резонно задаются вопросом, а настолько уж необходимы невидимые стяжки, или в мебельных изделиях есть места, где от изящности эксцентриков можно отказаться? Действительно в мебельных конструкциях масса «нерабочих» мест, (под нерабочими мы понимаем места, спрятанные от глаза, не на виду) которые могут прекрасно обойтись конфирматной стяжкой. Мощная шурупная стяжка (евровинт, конфирмат) заменит специфическую установку минификса, и обойдет его в конкурентной борьбе по цене, но не подготовительных деталях.
Обычно, (сейчас расскажем про ошибки) подготовительной работы никакой и нет вовсе – поставили вместе детали, которые требуют стяжки, сделали в них отверстие сверлом и закрутили конфирмат. Правильная же установка требует присадку деталей по аналогии с минификсами: с точной и кропотливой разметкой, обязательными шкантами, а уж в конце и стягивание.
Правильная же установка требует присадку деталей по аналогии с минификсами: с точной и кропотливой разметкой, обязательными шкантами, а уж в конце и стягивание.
Количество выбираемых отверстий в этом случае говорит в пользу конфирматов, всё-таки два против трёх это сила, и главное на 30% меньше работы.
Напомним сразу ещё об одной ошибке: многие мебельщики, обычно неопытные, считают, что чем сильнее они затянули винт, и прижали детали вместе, тем надежнее будет конструкция. А это как раз наоборот, сила возникающая в соединении вызовет в ЛДСП постепенную деформацию, разрушение соединений, скручивание и материал «поплывет». Так что всё в меру, затягиваем узловую конструкцию аккуратно, не до хруста, и ориентируемся в работе на главный мебельный алгоритм- соединяемые детали обездвиживаются и притягиваются друг к другу нежно.
Рафикс (Rafix)
Немецкими инженерами Хефеле разработана еще одна мебельная стяжка – Рафикс, которая настолько эстетична в своем исполнении, что прекрасна в любом мебельном изделии без заглушек. В отличие от минификса, этот крепеж, как и конфирмат, обойдется всего двумя отверстиями. Но по своей сути, это эксцентрик (со всеми его преимуществами), спрятанный в декоративный корпус из пластмассы и шток, поэтому целостность лицевого покрытия мебели обеспечено. Уникальностью стяжки является ее многофункциональность. Помимо того что она соединяет детали изделия, стяжка одновременно может выполнять функцию полкодержателя. Отныне никаких люфтов. Линейку Рафикс снабдили болтами и муфтами для любой программы монтажа.
В отличие от минификса, этот крепеж, как и конфирмат, обойдется всего двумя отверстиями. Но по своей сути, это эксцентрик (со всеми его преимуществами), спрятанный в декоративный корпус из пластмассы и шток, поэтому целостность лицевого покрытия мебели обеспечено. Уникальностью стяжки является ее многофункциональность. Помимо того что она соединяет детали изделия, стяжка одновременно может выполнять функцию полкодержателя. Отныне никаких люфтов. Линейку Рафикс снабдили болтами и муфтами для любой программы монтажа.
В завершении, хотелось бы напомнить простые правила, которыми следует руководствоваться при выборе мебельной стяжки:
1. К любой предполагаемой нагрузке, прибавьте 15% запаса
2. Если невидимости фурнитуры избежать не удаётся, сделайте её главным достоинством.
3. Пользуйтесь заглушками, если похвастаться фурнитурой не хватает бюджета.
4. Всегда учитывайте последующую разборку мебели.
Каталог мебельных стяжек
Посмотрите, как делают наши стяжки на заводе в Германии!
30.06.2016, 10106 просмотров.
Как правильно выбрать кухню?
Как же выбрать кухню из всего многообразия производителей? Кто–то «перегибает» цены, кто–то продает кухонные гарнитуры по подозрительно заниженной стоимости. Выбрать кухню высокого качества можно здесь, а ниже вы можете ознакомиться с инструкцией, как определить качество гарнитура.
1. Безвредное ЛДСП.
Если Вы выбираете кухню с фасадами из ЛДСП, то обратите внимание на качество материала. Что это значит? В дешевой мебели используется ЛДСП низкого качества. Вы поймете это по характерному запаху. Сказать, что это опасно для взрослого человека, не совсем правильно, это опасно для ребенка в возрасте до 6 лет, так как влияет на иммунитет. А что может быть дороже здоровья Вашего ребенка? Вы можете сказать себе, что через две недели запах выветрится. Но это не так. На самом деле, Вы просто привыкаете к нему, а выделение формальдегида не прекращается в течение всего срока службы мебели.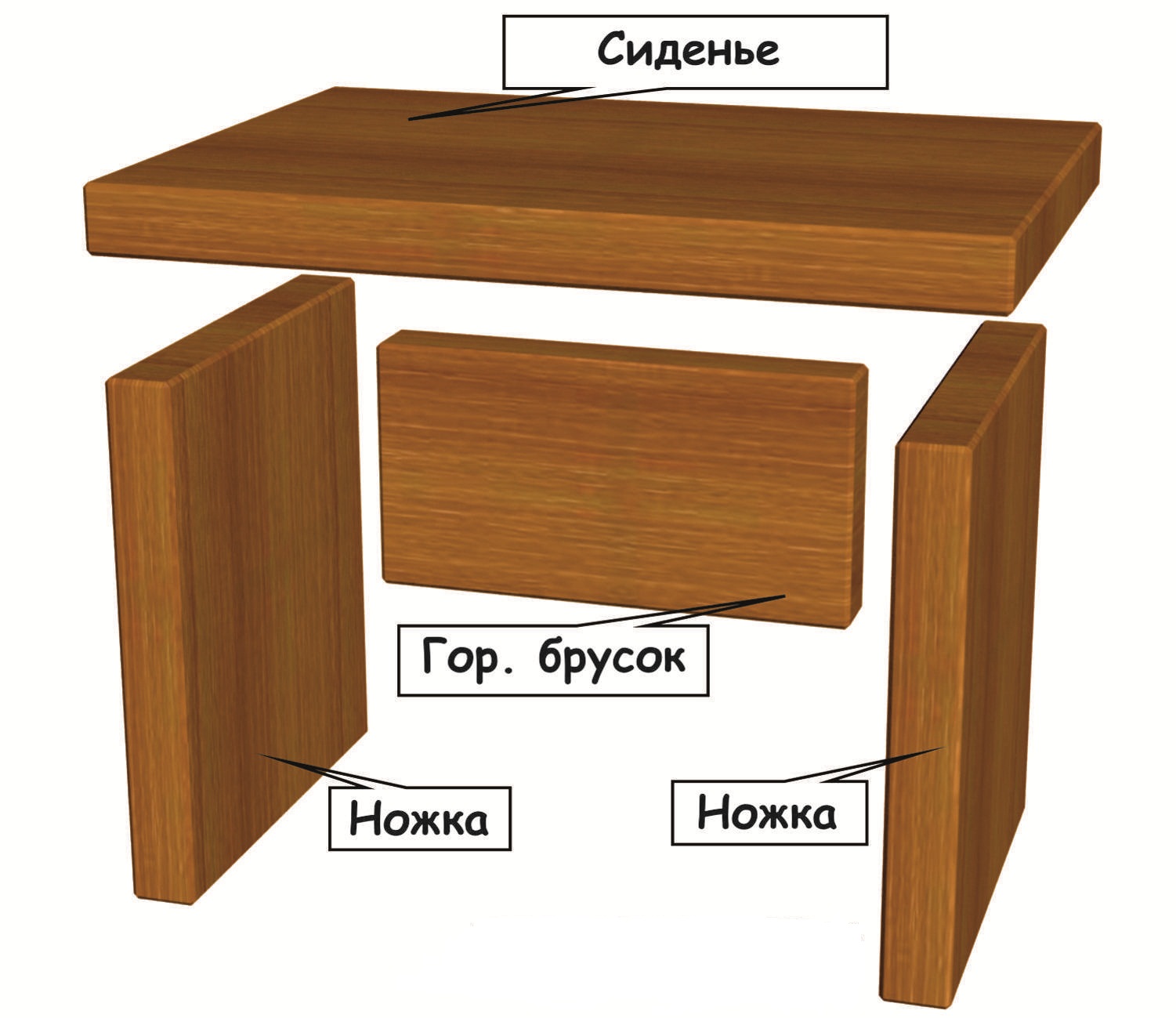 Подумайте о здоровье!
Подумайте о здоровье!
2. Толщина корпуса из ДСП.
Не секрет что корпуса кухонь всех популярных произхводителей производится из ДСП. Большинство фабрик используют дешевый ДСП толщиной 16мм. Представьте что будет если в такой ДСП вкрутить евровинт… толщина стенок в месте где вкручен винт будет минимальной, а ведь именно на этих винатх и держится весь гарнитур. Намного надежнее выбирать кухню, корпус которой выполнен из ДСП толщиной 18 мм.
3. Сроки службы корпуса.
Почему сроки службы кухонного гарнитура могут сильно отличаться? Основной фактор – это способ сборки корпуса, все зависит от того, как именно собирается кухонный гарнитур на производстве.
Существуют различные способы сборки корпуса, со своим сроком службы:
Конфирмат(Евровинт) – 6-7 лет;
Эксцентрик – 7-8 лет;
Шкант на клею – навсегда.
К сожалению, в условиях российских реалий, не редкостью являются кустарные методы сборки корпусов, например на строительных саморезах или строительных уголках. Заявляем со всей ответственностью — это грубое техническое нарушение. Такой вид соединений несет прямую опасность для жизни. Советуем сразу выяснить каким из методов производится сборка корпусов кухонноых гарнитуров.
Заявляем со всей ответственностью — это грубое техническое нарушение. Такой вид соединений несет прямую опасность для жизни. Советуем сразу выяснить каким из методов производится сборка корпусов кухонноых гарнитуров.
4. Обратить внимание на столешницу!
На самом деле выбор столешницы на российском рынке ограничен двумя видами: Ламинированный ДСП (ЛДСП). Ламинированный ДСП может быть влагостойкий или обычный. Как определить какой ЛДСП используется? Достаточно попросить образец столешницы у менеджера и взглянуть на разрез. Влагостойкий ЛДСП как правило имеет характерный зеленоватый оттенок.
Если Вам «посчастливится» приобрести столешницу из обычного ЛДСП, то будьте готовы, что через некоторое время на поверхности ламинированного слоя могут появится пузыри и вздутия.
Еще один вид столешниц — из «исскуственного камня». Здесь главное обратить внимание на толщину слоя. Стандартные варианты: 3мм, 6мм, 12мм. Чем толще слой тем выше ударопрочность поверхности.
5. Что нужно знать о фасадах.
Что нужно знать о фасадах.
Для начала расскажем о том, какие фасады бывают в общем случае:
МДФ массив
Шпон дерева
Пластиковые
МДФ бывает покрытый эмалью либо ПВХ. Если МДФ покрыт эмалью, то следует выяснить: какое количество слоев у данного покрытия. При правльной технологии производства данное покрытие должно иметь не менее 8 слоев (2 слоя грунта, 3 слоя краски, 3 слоя лака). Только в этом случае можно с уверенностью говорить о качественном производстве. Если же слоев меньше, то через 4-5 лет Ваш гарнитур поменяет цвет – «выгорит», потускнеет, станет бледнее.
Если в качестве покрытия МДФ используется глянцевая пленка, обратите внимание на уровень шагрени (эффект «апельсиновой корки»). Слегка заметная шагрень говорит о том, что пленка приклеена к фасаду максимально плотно.
При выборе классической кухни, будь то массив, либо ПВХ, необходимо обратить внимание на присутствие в модели сопроводительных аксессуаров (декоративные вставки, пилястры, фриз карниза, бандаж на вытяжке) и прочие декоры со специализированными и характерными профилю и отделке фасада рисунком. Все это говорит о том, что данная модель является авторской разработкой, по заказу фабрики – производителя мебели.
Все это говорит о том, что данная модель является авторской разработкой, по заказу фабрики – производителя мебели.
При выборе этой группы фасадов, необходимо обратить внимание на толщину покрытия. Возьмите образец данного фасада в разрезе и посмотрите на толщину покрытия (пластика). Если толщина 0,1-0,2 мм — это ламинированная бумага (меламин). Данный материал непрочный, легко царапается и деформируется, то есть – бюджетный. Некоторые производители могут выдавать этот материал за пластик. Минимальная допустимая толщина пластика — 0,6 мм. Данный материал является ударопрочным, не меняет свой цвет в течение всего срока службы, то есть является долговечным.
6. Проверяем качество сборки
Для начала попробуйте слегка нажать на нижнюю и верхнюю части фасада. Детали должны быть неподвижны, что означает что фасад плотно прилегает к корпусу. Далее зрительно оцените линию горизонта фасадов. По всей длине гарнитура она должна быть в один уровень. Расстояние между фасадами должно быть одинаковое и не более 2-3 мм.
Модульная сборка массивов CRISPR в одном горшке позволяет создавать библиотеки и выявлять факторы, влияющие на биогенез crRNA
Штаммы и условия роста
Дополнительная таблица 2 содержит список ключевых ресурсов, используемых в этой работе. Все штаммы, плазмиды и олигонуклеотиды перечислены в дополнительных таблицах 3 и 4. Для экспериментов с E. coli и TXTL SpCas9 экспрессировался из pCas9 (Addgene # 42876), тогда как другие гены cas экспрессировались под контролем промотор J23108 в основной цепи pBAD33.Плазмиды-мишени, используемые в анализах плазмидного клиренса для FnCas12a, были сконструированы с помощью мутагенеза Q5 (New England Biolabs) в соответствии с инструкциями производителя по удалению частей плазмиды pUA66-lacZ (ген GFP, управляемый промотором lacZ ), так что каждая целевая плазмида только содержат один протоспейсер, соответствующий разработанным проставкам. Плазмиды-мишени, используемые в анализах плазмидного клиренса для SpCas9, были сконструированы путем вставки фрагментов, содержащих PAM и протоспейсер, между сайтами Xho I и Bam HI pUA66. Репортерные плазмиды GFP, используемые в анализах репрессии генов, были сконструированы путем вставки конститутивного ( lacIQ ) или индуцибельного промотора ( lacZ или araB ) в сайты рестрикции Xho I и Bam HI перед сайтами рестрикции . Ген gfp в pUA66 (ссылка 51 ). Репортерная плазмида для обнаружения РНК in vitro с помощью LsCas13a представляла собой плазмиду p70a-deGFP, о которой ранее сообщалось 52 . Плазмиды, кодирующие мишень, были сконструированы путем встраивания протоспейсера в плазмиду pUA66_PJ23119 путем замены ORF гена GFP.Плазмиду p70a-deGFP также использовали для экспериментов по связыванию вне мишени путем вставки каждой целевой последовательности выше промотора P70a с использованием мутагенеза Q5. Плазмиды, кодирующие Cas12a, были сконструированы путем вставки открытой рамки считывания FnCas12a или AsCas12a в pBAD33 с конститутивным промотором (PJ23108). Плазмиды, кодирующие варианты dFnCas12a, были сконструированы с помощью мутагенеза Q5 с использованием плазмиды FnCas12a в качестве матрицы.
 Плазмида, использованная для экспрессии Cas9, представляла собой pCas9 (Addgene # 42876). Плазмида pCas9-notracr была сконструирована путем удаления части tracrRNA из плазмиды pCas9 с использованием мутагенеза Q5.Плазмиду pcDNA3.1-hFnCpf1 (Addgene # 69976) использовали для экспрессии FnCas12a в клетках HEK293T. Анализ плазмидного клиренса in vivo проводили в CB414, производном E. coli BW25113 с промотором lacI через ген lacZ и удаленной системой CRISPR-Cas эндогенного I-E.
Плазмида, использованная для экспрессии Cas9, представляла собой pCas9 (Addgene # 42876). Плазмида pCas9-notracr была сконструирована путем удаления части tracrRNA из плазмиды pCas9 с использованием мутагенеза Q5.Плазмиду pcDNA3.1-hFnCpf1 (Addgene # 69976) использовали для экспрессии FnCas12a в клетках HEK293T. Анализ плазмидного клиренса in vivo проводили в CB414, производном E. coli BW25113 с промотором lacI через ген lacZ и удаленной системой CRISPR-Cas эндогенного I-E.
Клетки E. coli выращивали в среде Luria Bertani (LB) (10 г / л NaCl, 5 г / л дрожжевого экстракта, 10 г / л триптона) при 37 ° C со встряхиванием при 250 об / мин. Добавляли антибиотики ампициллин, хлорамфеникол и / или канамицин для поддержания любых плазмид на уровне 50 мкг / мл, 34 мкг / мл и 50 мкг / мл соответственно.Индукторы Изопропил-β-D-1-тиогалактопиранозид (IPTG) или l-арабиноза добавляли в концентрациях 0,2 мМ и 0,2%, если указано.
Штамм S. cerevisiae YPH500 (Stratagene) был использован в качестве фонового штамма для активации гена.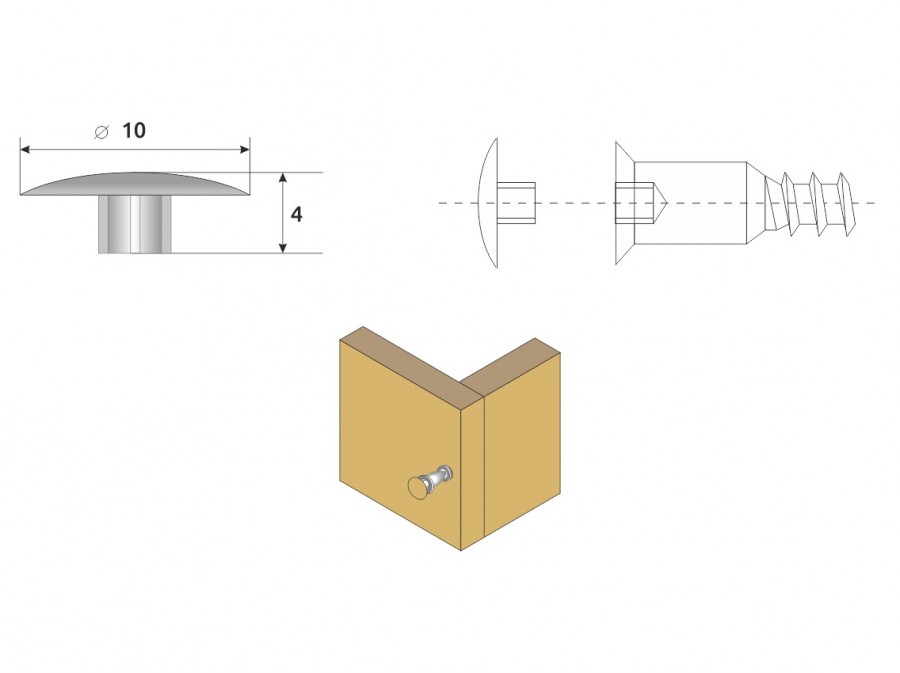 Культивирование и генетическая трансформация были выполнены с использованием стандартных лабораторных методов 53 с использованием URA3, HIS3 или LEU2 в качестве селектируемых маркеров. Репортерная плазмида для активации гена была сконструирована из интегративной плазмиды pRS406 (Stratagene) аналогично предыдущей работе с использованием стандартных методик 54 .В частности, плазмиду CEN pRS414 использовали для экспрессии вариантов FnCas12a с промотора GPD. Для конструирования FnCas12a-VP64 двойной мутант FnCas12a был клонирован между pGPD и VP64 в pRS414 посредством сборки Гибсона. Все плазмидные конструкции были созданы с использованием электрокомпетентных клеток TOP10, Novablue, Tg1 или DH5α и проверены с помощью ПЦР и секвенирования по Сэнгеру вставленной последовательности.
Культивирование и генетическая трансформация были выполнены с использованием стандартных лабораторных методов 53 с использованием URA3, HIS3 или LEU2 в качестве селектируемых маркеров. Репортерная плазмида для активации гена была сконструирована из интегративной плазмиды pRS406 (Stratagene) аналогично предыдущей работе с использованием стандартных методик 54 .В частности, плазмиду CEN pRS414 использовали для экспрессии вариантов FnCas12a с промотора GPD. Для конструирования FnCas12a-VP64 двойной мутант FnCas12a был клонирован между pGPD и VP64 в pRS414 посредством сборки Гибсона. Все плазмидные конструкции были созданы с использованием электрокомпетентных клеток TOP10, Novablue, Tg1 или DH5α и проверены с помощью ПЦР и секвенирования по Сэнгеру вставленной последовательности.
Создание массивов CRISPR в одном горшке
Плазмида остова, используемая для создания массивов CRISPR для FnCas12a (pFnCpf1GG), была сконструирована сборкой Гибсона для соединения трех фрагментов ПЦР вместе и уничтожения дополнительного сайта BsmBI на остове каркаса. Три ПЦР-фрагмента содержат конститутивный промотор J23119, конструкцию GFP-dropout (с промотором и терминатором), фланкированную двумя сайтами рестрикции BsmBI типа IIS и прямым повторением FnCas12a, и терминатор rrnB , ген устойчивости к ампициллину и источник pMB1 репликация соответственно. Плазмида остова, использованная для создания массивов для AsCas12a и LsCas13a, и составные массивы с четырьмя спейсерами были сконструированы с использованием мутагенеза Q5 для удаления повтора FnCas12a и вставки других соответствующих повторов.Плазмида остова, используемая для создания массивов для SpCas9, была сконструирована путем вставки фрагмента ПЦР с прямым повтором Cas9 и сайтами BsmBI, фланкированными выпадающей конструкцией mRFP, в pFnCpf1GG, расщепленную AatII и HindIII. Плазмида остова для создания составных массивов для блокирования расщепления вне мишени была сконструирована с использованием мутагенеза Q5 для удаления лишних нуклеотидов на 3′-промоторе от pFnCpf1GG, так что транскрипция начинается с sgRNA Cas9.
Три ПЦР-фрагмента содержат конститутивный промотор J23119, конструкцию GFP-dropout (с промотором и терминатором), фланкированную двумя сайтами рестрикции BsmBI типа IIS и прямым повторением FnCas12a, и терминатор rrnB , ген устойчивости к ампициллину и источник pMB1 репликация соответственно. Плазмида остова, использованная для создания массивов для AsCas12a и LsCas13a, и составные массивы с четырьмя спейсерами были сконструированы с использованием мутагенеза Q5 для удаления повтора FnCas12a и вставки других соответствующих повторов.Плазмида остова, используемая для создания массивов для SpCas9, была сконструирована путем вставки фрагмента ПЦР с прямым повтором Cas9 и сайтами BsmBI, фланкированными выпадающей конструкцией mRFP, в pFnCpf1GG, расщепленную AatII и HindIII. Плазмида остова для создания составных массивов для блокирования расщепления вне мишени была сконструирована с использованием мутагенеза Q5 для удаления лишних нуклеотидов на 3′-промоторе от pFnCpf1GG, так что транскрипция начинается с sgRNA Cas9.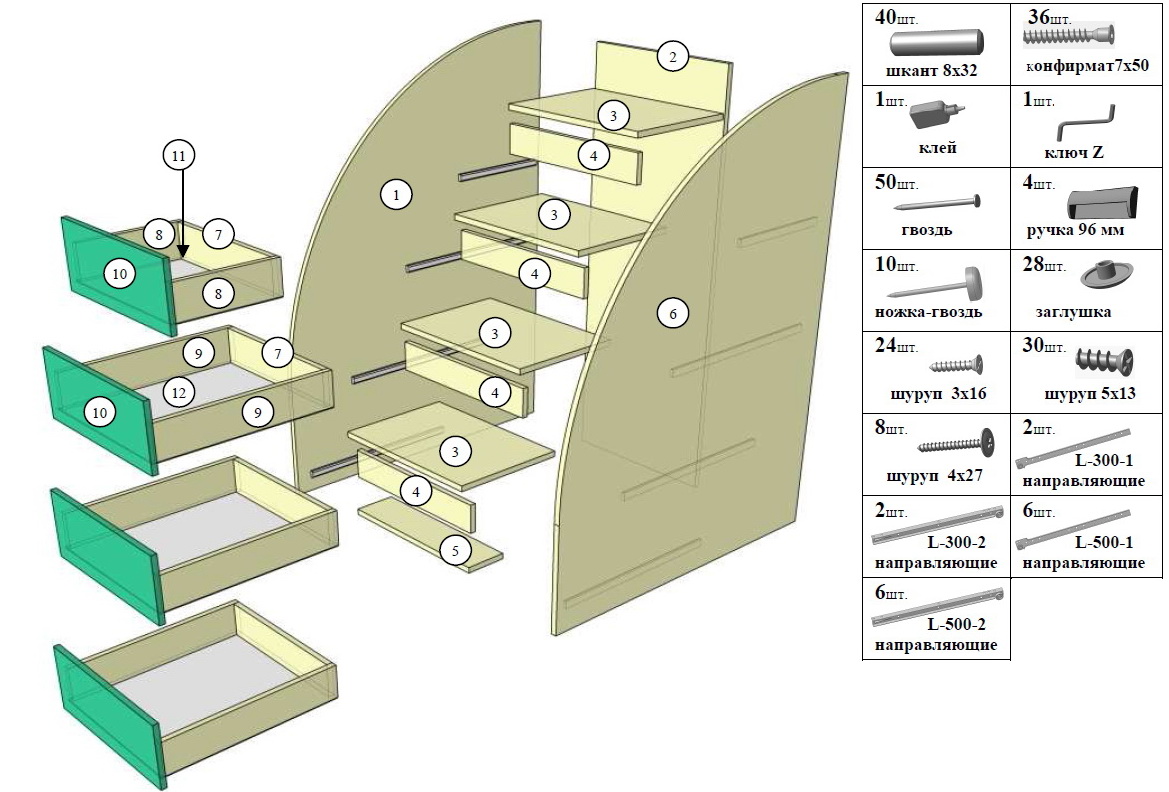 Плазмида остова для создания массивов для использования в дрожжах была сконструирована с использованием сборки Гибсона для соединения трех фрагментов ПЦР и мутации сайта BsaI на остове каркаса: сайты BsaI фланкировали конструкцию с выпадением GFP и два фрагмента ПЦР, амплифицированных из плазмиды pRS413, на которой расположены массивы. транскрибируется с промотора snoRNA SNR52.Последовательности полученных остовных плазмид доступны в дополнительной таблице 2. Прямые и обратные олигонуклеотиды, кодирующие один повтор, один спейсер и 4-нуклеотидное соединение, фосфорилировали и отжигали с образованием дцДНК с 5′- и / или 3′-выступами. В целом, 400 фмоль каждой дцДНК, 20 фмоль остовной плазмиды, 1 мкл лигазы Т4 и 1 мкл BsmBI или BsaI добавляли к 2 мкл буфера для лигирования Т4, затем добавляли воду для достижения общего объема 20 мкл. . Термоциклер использовался для выполнения 25 циклов разложения и лигирования (42 ° C в течение 2 минут, 16 ° C в течение 5 минут) с последующим заключительным этапом разложения (60 ° C в течение 10 минут) и этапом тепловой инактивации (80 ° C).
Плазмида остова для создания массивов для использования в дрожжах была сконструирована с использованием сборки Гибсона для соединения трех фрагментов ПЦР и мутации сайта BsaI на остове каркаса: сайты BsaI фланкировали конструкцию с выпадением GFP и два фрагмента ПЦР, амплифицированных из плазмиды pRS413, на которой расположены массивы. транскрибируется с промотора snoRNA SNR52.Последовательности полученных остовных плазмид доступны в дополнительной таблице 2. Прямые и обратные олигонуклеотиды, кодирующие один повтор, один спейсер и 4-нуклеотидное соединение, фосфорилировали и отжигали с образованием дцДНК с 5′- и / или 3′-выступами. В целом, 400 фмоль каждой дцДНК, 20 фмоль остовной плазмиды, 1 мкл лигазы Т4 и 1 мкл BsmBI или BsaI добавляли к 2 мкл буфера для лигирования Т4, затем добавляли воду для достижения общего объема 20 мкл. . Термоциклер использовался для выполнения 25 циклов разложения и лигирования (42 ° C в течение 2 минут, 16 ° C в течение 5 минут) с последующим заключительным этапом разложения (60 ° C в течение 10 минут) и этапом тепловой инактивации (80 ° C). в течение 10 мин).Затем смесь для лигирования разбавляли 1: 6 водой и электропорировали в компетентные клетки E. coli . После трансформации и восстановления в течение 1 часа при 37 ° C со встряхиванием при 250 об / мин в среде SOC клетки высевали на агар LB, содержащий соответствующий антибиотик, и инкубировали в течение 16 часов. Затем белые колонии подвергали скринингу на предмет наличия полосы правильного размера, и массив проверяли путем секвенирования по Сэнгеру продукта ПЦР. Подробный протокол и пример сборки одного из массивов FnCas12a с тремя разделителями см. В разделе «Дополнительные методы».
в течение 10 мин).Затем смесь для лигирования разбавляли 1: 6 водой и электропорировали в компетентные клетки E. coli . После трансформации и восстановления в течение 1 часа при 37 ° C со встряхиванием при 250 об / мин в среде SOC клетки высевали на агар LB, содержащий соответствующий антибиотик, и инкубировали в течение 16 часов. Затем белые колонии подвергали скринингу на предмет наличия полосы правильного размера, и массив проверяли путем секвенирования по Сэнгеру продукта ПЦР. Подробный протокол и пример сборки одного из массивов FnCas12a с тремя разделителями см. В разделе «Дополнительные методы».
Контроль без спейсера, используемый в большинстве экспериментов, был получен путем вставки одного повтора в плазмиду остова, что приводило к двум последовательным повторам без промежуточного спейсера.
Составные массивы для скоординированного клиренса плазмиды и репрессии гена были созданы с использованием того же метода, за исключением того, что остовная плазмида имела 5’-прямой повтор для SpCas9 и 3’-прямой повтор для FnCas12a. Составные массивы для уменьшения отклонения от цели были созданы путем сборки sgRNA Cas9 и двух дцДНК с повторением-спейсером в выпадающий остов GFP.SgRNA была сформирована с двумя отожженными олигонуклеотидами в соответствии с CRATES.
Составные массивы для уменьшения отклонения от цели были созданы путем сборки sgRNA Cas9 и двух дцДНК с повторением-спейсером в выпадающий остов GFP.SgRNA была сформирована с двумя отожженными олигонуклеотидами в соответствии с CRATES.
Плазмиды, кодирующие массивы из семи спейсеров, управляемые промоторами CMV, были сконструированы сборкой Гибсона с использованием каждого из трех фрагментов ДНК. Один фрагмент амплифицировали из плазмиды pCB871, которая содержала массив из семи спейсеров, созданный с использованием CRATES, с консенсусным повтором в качестве концевого повтора или с нативным концевым повтором. Два других фрагмента представляли собой скелет, амплифицированный из плазмиды pMZ-DF-JEV, подаренной Dr.Нева Калискан.
Создание библиотеки массивов CRISPR в одном горшке
pFnCpf1GG использовалось в качестве основы для создания библиотеки массивов CRISPR. Чтобы создать библиотеку массивов из трех спейсеров с пятью вариантами спейсеров в каждом локусе спейсера, из Integrated Device Technology (IDT) были синтезированы тридцать прямых и обратных олигонуклеотидов, каждый из которых кодирует один повтор, один спейсер и 4-нуклеотидное соединение. Как часть дизайна библиотеки, 5 ‘и 3′ последовательности соединений сборки использовались для всех пар повтор-спейсер, предназначенных для одной и той же позиции в массиве (например,g. спейсеры S1a-e, предназначенные для 5′-положения в матрице из трех спейсеров, включали отожженные олигонуклеотиды с 5′-выступом CCCT на 5′-конце и 3′-выступом GCTG на 3′-конце). В остальном дизайн олигонуклеотидов точно соответствовал тому, что указано в разделе «Создание массивов CRISPR в одном горшке». Дополнительная таблица 4 содержит конкретные олигонуклеотиды и соединения сборки, используемые для создания библиотеки. Олиго фосфорилировали и отжигали с образованием дцДНК с 5′- и / или 3’-выступами. Всего 400 фмоль каждой дцДНК, 20 фмоль остова плазмиды, 0.5 мкл лигазы Т4 (1000 единиц) и 1,5 мкл BsmBI (15 единиц) добавляли к 2 мкл 10x буфера для лигирования Т4, затем добавляли воду до достижения общего объема 20 мкл. Термоциклер использовали для выполнения 35 циклов расщепления и лигирования (42 ° C в течение 2 минут, 16 ° C в течение 5 минут) с последующим заключительным этапом разложения (60 ° C в течение 10 минут) и этапом тепловой инактивации (80 ° C).
Как часть дизайна библиотеки, 5 ‘и 3′ последовательности соединений сборки использовались для всех пар повтор-спейсер, предназначенных для одной и той же позиции в массиве (например,g. спейсеры S1a-e, предназначенные для 5′-положения в матрице из трех спейсеров, включали отожженные олигонуклеотиды с 5′-выступом CCCT на 5′-конце и 3′-выступом GCTG на 3′-конце). В остальном дизайн олигонуклеотидов точно соответствовал тому, что указано в разделе «Создание массивов CRISPR в одном горшке». Дополнительная таблица 4 содержит конкретные олигонуклеотиды и соединения сборки, используемые для создания библиотеки. Олиго фосфорилировали и отжигали с образованием дцДНК с 5′- и / или 3’-выступами. Всего 400 фмоль каждой дцДНК, 20 фмоль остова плазмиды, 0.5 мкл лигазы Т4 (1000 единиц) и 1,5 мкл BsmBI (15 единиц) добавляли к 2 мкл 10x буфера для лигирования Т4, затем добавляли воду до достижения общего объема 20 мкл. Термоциклер использовали для выполнения 35 циклов расщепления и лигирования (42 ° C в течение 2 минут, 16 ° C в течение 5 минут) с последующим заключительным этапом разложения (60 ° C в течение 10 минут) и этапом тепловой инактивации (80 ° C). в течение 10 мин). Затем пять микролитров смеси для лигирования трансформировали в химически компетентные клетки E. coli . Обратите внимание, что очищенный и концентрированный продукт лигирования и электрокомпетент E.coli можно использовать для повышения эффективности трансформации для создания большой библиотеки. После трансформации и восстановления в 500 мкл SOC в течение 1 ч при 37 ° C со встряхиванием при 250 об / мин, 10 мкл клеток высевали на агар LB, содержащий соответствующий антибиотик, и инкубировали в течение 16 ч для проверки количества и цвета полученных колоний. Оставшуюся часть выделенной культуры добавляли в 15 мл среды LB, содержащей соответствующий антибиотик, и инкубировали при 37 ° C со встряхиванием при 250 об / мин до OD 600 ≈ 1.Клетки собирали центрифугированием и подвергали плазмидной экстракции. Извлеченные плазмиды использовали в качестве матрицы для ПЦР для создания библиотеки ДНК для секвенирования следующего поколения.
в течение 10 мин). Затем пять микролитров смеси для лигирования трансформировали в химически компетентные клетки E. coli . Обратите внимание, что очищенный и концентрированный продукт лигирования и электрокомпетент E.coli можно использовать для повышения эффективности трансформации для создания большой библиотеки. После трансформации и восстановления в 500 мкл SOC в течение 1 ч при 37 ° C со встряхиванием при 250 об / мин, 10 мкл клеток высевали на агар LB, содержащий соответствующий антибиотик, и инкубировали в течение 16 ч для проверки количества и цвета полученных колоний. Оставшуюся часть выделенной культуры добавляли в 15 мл среды LB, содержащей соответствующий антибиотик, и инкубировали при 37 ° C со встряхиванием при 250 об / мин до OD 600 ≈ 1.Клетки собирали центрифугированием и подвергали плазмидной экстракции. Извлеченные плазмиды использовали в качестве матрицы для ПЦР для создания библиотеки ДНК для секвенирования следующего поколения.
Плазмидный клиренс в
E. coli
coli Мы трансформировали 50 нг плазмиды, кодирующей массив CRISPR или не нацеливающий контроль без спейсера, в клеток E. coli , несущих плазмиду, кодирующую белок Cas, и другую плазмиду, кодирующую целевую последовательность crRNA.После восстановления в течение одного часа в SOC при 37 ° C при встряхивании при 250 об / мин клетки серийно разводили и 10 мкл капли высевали на чашки с агаром LB с ампициллином, канамицином и хлорамфениколом. После 16 ч роста количество колоний записывали для анализа.
Репрессия гена в
E. coli Клетки CB414 были первоначально трансформированы тремя совместимыми плазмидами: плазмидой, кодирующей вариант FnCas12a, плазмидой, кодирующей массив CRISPR или контролем без спейсера, и плазмидой, кодирующей GFP под контролем lacZ , lacIQ , или промотор araB .Ночные культуры клеток, несущих три плазмиды, разводили обратно до ABS 600 ~ 0,01 в среде LB с ампициллином, канамицином и хлорамфениколом и индуктором промотора и встряхивали при 250 об / мин при 37 ° C до достижения ABS 600 ~ 0,2. Затем культуры разбавляли 1:25 в 1x фосфатно-солевом буфере (PBS) и анализировали на проточном цитометре Accuri C6 с загрузчиком планшетов с пробоотборником C6 (Becton Dickinson), оснащенным пробоотборником для планшетов CFlow, 488-нм лазером и 530 + / — полосовой фильтр 15 нм.Флуоресценцию GFP измеряли аналогично предыдущей работе 55 . Вкратце, прямое рассеяние (отсечка 15 500) и боковое рассеяние (отсечка 600) использовались для исключения неклеточных событий. Среднее значение в пределах FL1-H 30 000 событий в пределах набора ворот для E. coli использовалось для анализа данных 56 .
Затем культуры разбавляли 1:25 в 1x фосфатно-солевом буфере (PBS) и анализировали на проточном цитометре Accuri C6 с загрузчиком планшетов с пробоотборником C6 (Becton Dickinson), оснащенным пробоотборником для планшетов CFlow, 488-нм лазером и 530 + / — полосовой фильтр 15 нм.Флуоресценцию GFP измеряли аналогично предыдущей работе 55 . Вкратце, прямое рассеяние (отсечка 15 500) и боковое рассеяние (отсечка 600) использовались для исключения неклеточных событий. Среднее значение в пределах FL1-H 30 000 событий в пределах набора ворот для E. coli использовалось для анализа данных 56 .
Обнаружение мультиплексной РНК in vitro с помощью Cas13a
Открытая рамка считывания LsCas13a была клонирована в pBAD33 с конститутивным промотором. Один или несколько наборов спейсеров были созданы, как описано выше.Нацеленные РНК транскрибировали с использованием конститутивного промотора плазмиды. В качестве репортера использовали плазмиду, конститутивно экспрессирующую белок deGFP. Плазмиду, кодирующую Cas13a, плазмиду, кодирующую матрицу, и плазмиду, кодирующую мишень, добавляли в 9 мкл мастер-смеси MyTXTL (Arbor Biosciences) до конечной концентрации 2 нМ, 1 нМ и 0,5 нМ, соответственно, до общего объема 12 мкл и инкубируют при 37 ° C в течение 2 часов. Затем добавляли репортерную плазмиду до конечной концентрации 0,5 нМ.Аликвоты по 5 мкл помещали в лунки 96-луночного планшета с V-образным дном (Corning Costar 3357) и инкубировали при 37 ° C в течение 16 ч в считывающем устройстве для микропланшетов Synergy h2MF (BioTek) с кинетическим считыванием каждые 3 мин (возбуждение, испускание). : 485 нм, 528 нм; усиление: 60; источник света: ксеноновая вспышка).
Активация гена в
Saccharomyces cerevisiae Три одиночные дрожжевые колонии для каждого штамма отбирали после трансформации плазмид и инокулировали в 500 мл SD-среды (синтетическая выпадающая среда, содержащая 2% глюкозы с определенными смесями аминокислот) в 96-луночных аналитических блоках Costar (V-образное дно; 2 максимальный объем мл; Fisher Scientific). Культуры выращивали при 30 ° C и встряхивании 250 об / мин в течение 24–48 ч. Затем культуры повторно инокулировали в SD-полную среду до OD 600 от 0,05 до 0,1 и выращивали при 30 ° C со встряхиванием 250 об / мин в течение 12 часов. Клетки обрабатывали циклогексимидом 10 мг / мл для ингибирования синтеза белка и затем анализировали на экспрессию yEGFP с помощью проточной цитометрии. Всего было зарегистрировано 10 000 событий с использованием проточного цитометра MACSQuant VYB с пробоотборником для 96-луночных планшетов. События регистрировались с помощью прямого и бокового рассеяния, и все полученные значения были получены от трех изогенных штаммов.Графики были построены на основе бокового рассеяния по сравнению с флуоресценцией FL1. См. Дополнительный рис. 3D для репрезентативных графиков.
Культуры выращивали при 30 ° C и встряхивании 250 об / мин в течение 24–48 ч. Затем культуры повторно инокулировали в SD-полную среду до OD 600 от 0,05 до 0,1 и выращивали при 30 ° C со встряхиванием 250 об / мин в течение 12 часов. Клетки обрабатывали циклогексимидом 10 мг / мл для ингибирования синтеза белка и затем анализировали на экспрессию yEGFP с помощью проточной цитометрии. Всего было зарегистрировано 10 000 событий с использованием проточного цитометра MACSQuant VYB с пробоотборником для 96-луночных планшетов. События регистрировались с помощью прямого и бокового рассеяния, и все полученные значения были получены от трех изогенных штаммов.Графики были построены на основе бокового рассеяния по сравнению с флуоресценцией FL1. См. Дополнительный рис. 3D для репрезентативных графиков.
Оценка блокирования нецелевого расщепления in vitro
Отдельные направляющие для расщепления Cas9, массивы с одним спейсером для dFnCpf1, блокирующие нецелевые сайты, и составные массивы для синхронного расщепления и блокирования были созданы, как описано в разделе Массивы CRISPR ». Протоспейсеры клонировали выше конститутивного промотора гена GFP на плазмиде.Плазмида, кодирующая dFnCpf1, нацеливающая плазмида для Cas9, нацеливающая плазмида для dFnCpf1, составной массив Psg / b1 / b2, составной массив Psg / b2 / b1 или нецелевой контроль, и одна из трех целевых плазмид были добавлены в мастер-микс MyTXTL . до конечной концентрации 1 нМ, 2 нМ и 0,5 нМ, соответственно, и инкубировали при 29 ° C в течение 4 часов. Затем к смеси добавляли плазмиду, кодирующую SpCas9 (pCas9-notracr), до конечной концентрации 2 нМ и инкубировали при 29 ° C в течение 16 ч в микропланшет-ридере с кинетическим считыванием (возбуждение, испускание: 485 нм, 528 нм) каждые 3 мин.Нецелевой контроль также был протестирован в качестве контроля.
Протоспейсеры клонировали выше конститутивного промотора гена GFP на плазмиде.Плазмида, кодирующая dFnCpf1, нацеливающая плазмида для Cas9, нацеливающая плазмида для dFnCpf1, составной массив Psg / b1 / b2, составной массив Psg / b2 / b1 или нецелевой контроль, и одна из трех целевых плазмид были добавлены в мастер-микс MyTXTL . до конечной концентрации 1 нМ, 2 нМ и 0,5 нМ, соответственно, и инкубировали при 29 ° C в течение 4 часов. Затем к смеси добавляли плазмиду, кодирующую SpCas9 (pCas9-notracr), до конечной концентрации 2 нМ и инкубировали при 29 ° C в течение 16 ч в микропланшет-ридере с кинетическим считыванием (возбуждение, испускание: 485 нм, 528 нм) каждые 3 мин.Нецелевой контроль также был протестирован в качестве контроля.
Блокирование вне мишени также оценивалось в TXTL, когда целевые и нецелевые сайты существовали в одном банке, с использованием секвенирования следующего поколения. Плазмида, кодирующая dFnCpf1, составной массив Psg / b1 / b2, составной массив psg / b2 / b1 или нецелевой контроль, и все три целевые плазмиды были добавлены в мастер-микс MyTXTL до конечной концентрации 1 нМ, 2 нМ, и 0,5 нМ, соответственно, и инкубировали при 29 ° C в течение 4 часов. Затем к смеси добавляли плазмиду, кодирующую SpCas9 (pCas9-notracr), до конечной концентрации 2 нМ и инкубировали при 29 ° C в течение 8 часов.Плазмиды экстрагировали из реакции TXTL и использовали в качестве матрицы для ПЦР для создания библиотеки ДНК для секвенирования следующего поколения.
Затем к смеси добавляли плазмиду, кодирующую SpCas9 (pCas9-notracr), до конечной концентрации 2 нМ и инкубировали при 29 ° C в течение 8 часов.Плазмиды экстрагировали из реакции TXTL и использовали в качестве матрицы для ПЦР для создания библиотеки ДНК для секвенирования следующего поколения.
кРНК в TXTL
Плазмиды, кодирующие FnCas12a, и массивы добавляли в 9 мкл мастер-микса MyTXTL (Arbor Biosciences) до конечной концентрации 5 нМ в каждой пробирке для ПЦР и общим объемом 12 мкл. Два микромоля отожженных олигонуклеотидов Chi6 были включены в реакцию для предотвращения любой непреднамеренной деградации плазмид белками RecBCD.Смесь инкубировали при 29 ° C в течение пяти часов в термоциклере и общую РНК экстрагировали с использованием набора Direct-zol RNA MiniPrep, следуя инструкциям производителя (Zymo Research).
Культура клеток млекопитающих и трансфекция
Клетки эмбриональной почки человека 293T (HEK293T) (подарок лаборатории Редмонда Смита) выращивали при 37 ° C с 5% CO. 2 в среде Игла, модифицированной Дульбекко (DMEM, Gibco) содержащий 10% сыворотки теленка с добавками железа (Sigma) и 1% пенициллин-стрептомицин (Gibco).Клетки высевали в шестилуночные планшеты (Corning) и трансфицировали при 50% конфлюэнтности, используя 1 мг / мл полиэтиленимина (PEI, Polysciences), приготовленного в соответствии с инструкциями производителя. Котрансфекции выполняли путем добавления в каждую лунку 100 мкл DMEM, содержащей 300 нг плазмиды, кодирующей FnCpf1, 300 нг плазмиды, кодирующей матрицу CRISPR, и 7,2 мкл 1 мг / мл PEI. Через 48 часов после трансфекции клетки промывали фосфатно-солевым буфером (PBS, Gibco) и непосредственно лизировали, используя 900 мкл TRIzol (Zymo Research) на лунку.Тотальную РНК экстрагировали с использованием набора Direct-zol RNA MiniPrep (Zymo Research), следуя инструкциям производителя.
2 в среде Игла, модифицированной Дульбекко (DMEM, Gibco) содержащий 10% сыворотки теленка с добавками железа (Sigma) и 1% пенициллин-стрептомицин (Gibco).Клетки высевали в шестилуночные планшеты (Corning) и трансфицировали при 50% конфлюэнтности, используя 1 мг / мл полиэтиленимина (PEI, Polysciences), приготовленного в соответствии с инструкциями производителя. Котрансфекции выполняли путем добавления в каждую лунку 100 мкл DMEM, содержащей 300 нг плазмиды, кодирующей FnCpf1, 300 нг плазмиды, кодирующей матрицу CRISPR, и 7,2 мкл 1 мг / мл PEI. Через 48 часов после трансфекции клетки промывали фосфатно-солевым буфером (PBS, Gibco) и непосредственно лизировали, используя 900 мкл TRIzol (Zymo Research) на лунку.Тотальную РНК экстрагировали с использованием набора Direct-zol RNA MiniPrep (Zymo Research), следуя инструкциям производителя.
Секвенирование подготовки библиотеки малых РНК и анализ данных
Выделенную тотальную РНК обрабатывали Турбо-ДНКазой (Life Technologies) и 3′-дефосфорилировали полинуклеотидкиназой Т4 (New England Biolabs), затем рРНК удаляли с помощью набора Ribo-Zero Kit (Бактерии или H / M / R) (Illumina) в соответствии с инструкциями производителя. Библиотеки РНК получали с использованием набора для подготовки библиотеки малых РНК NEBNext Multiplex для Illumina (New England Biolabs) в соответствии с инструкциями производителя.Образцы секвенировали на машине MiSeq (Illumina) в лаборатории геномных наук в Университете штата Северная Каролина. Программный пакет Geneious 10.2.3 (Biomatters) использовался для сортировки и сопоставления данных. Вкратце, чтения Fastq были обрезаны и отфильтрованы по качеству с помощью плагина BBDuk. Затем обрезанные чтения были сопоставлены с созданными эталонными последовательностями массива CRISPR с использованием Geneious 10.2.3 ‘Map to Reference.
Библиотеки РНК получали с использованием набора для подготовки библиотеки малых РНК NEBNext Multiplex для Illumina (New England Biolabs) в соответствии с инструкциями производителя.Образцы секвенировали на машине MiSeq (Illumina) в лаборатории геномных наук в Университете штата Северная Каролина. Программный пакет Geneious 10.2.3 (Biomatters) использовался для сортировки и сопоставления данных. Вкратце, чтения Fastq были обрезаны и отфильтрованы по качеству с помощью плагина BBDuk. Затем обрезанные чтения были сопоставлены с созданными эталонными последовательностями массива CRISPR с использованием Geneious 10.2.3 ‘Map to Reference.
Секвенирование следующего поколения и анализ данных
интересующих участков ДНК были амплифицированы из экстрагированных плазмид.Используемые праймеры содержали необходимые адаптеры для анализа с помощью Illumina MiSeq:
Fwd 5′-TCGTCGCAGCGTCAGATGTGTATAAGAGACAG-3 ‘
Rev 5′-GTCTCGTGGGCTCGGAGATGTGTATAAGAGACAG-3′ -Column) (Zymo Research), следуя инструкциям производителя, чтобы удалить излишки праймеров и возможные димеры праймеров. Затем очищенную ДНК проиндексировали с помощью восьми циклов амплификации с использованием индексов Nextera E502, E503, E504, E505 и N707.Полученные продукты ДНК снова очищали с использованием очистителя и концентратора Select-a-Size DNA (спин-колонка) (Zymo Research), следуя инструкциям производителя. Образцы с разными индексами объединяли вместе как 10 нМ в общем объеме 20 мкл и отправляли в Core Unit Systemmedizin (Вюрцбург, Германия) для парного секвенирования 2 × 150 п.н. в глубину. Полученные данные секвенирования были отсортированы по индексам и обрезаны для количественной оценки каждого массива с использованием Salmon на платформе Galaxy Version 0.9.1 (https://usegalaxy.org/). Лосось был разработан как инструмент для количественной оценки транскриптов по данным RNA-seq. мы изменили его задачу для количественной оценки количества различных массивов, сравнивая считывания ДНК с эталонными последовательностями 125 массивов, которые мы намеревались собрать. KmerLen был установлен на 31, и в качестве типа индекса был выбран квази для построения 57 .
Затем очищенную ДНК проиндексировали с помощью восьми циклов амплификации с использованием индексов Nextera E502, E503, E504, E505 и N707.Полученные продукты ДНК снова очищали с использованием очистителя и концентратора Select-a-Size DNA (спин-колонка) (Zymo Research), следуя инструкциям производителя. Образцы с разными индексами объединяли вместе как 10 нМ в общем объеме 20 мкл и отправляли в Core Unit Systemmedizin (Вюрцбург, Германия) для парного секвенирования 2 × 150 п.н. в глубину. Полученные данные секвенирования были отсортированы по индексам и обрезаны для количественной оценки каждого массива с использованием Salmon на платформе Galaxy Version 0.9.1 (https://usegalaxy.org/). Лосось был разработан как инструмент для количественной оценки транскриптов по данным RNA-seq. мы изменили его задачу для количественной оценки количества различных массивов, сравнивая считывания ДНК с эталонными последовательностями 125 массивов, которые мы намеревались собрать. KmerLen был установлен на 31, и в качестве типа индекса был выбран квази для построения 57 .
Нозерн-блоттинг-анализ
Клетки CB414 первоначально трансформировали двумя совместимыми плазмидами: плазмидой FnCas12a и матричной плазмидой PcF-2/3/1 или PcF-3/2/1.Ночные культуры клеток, несущих две плазмиды, разводили обратно до уровня ABS 600 ~ 0,01 в среде LB с ампициллином и хлорамфениколом и встряхивали при 250 об / мин при 37 ° C до тех пор, пока ABS 600 не достигнет ~ 0,6. Клетки собирали центрифугированием, и общую РНК экстрагировали с использованием реагента Direct-zol и набора Direct-zol RNA MiniPrep (Zymo Research) в соответствии с инструкциями производителя с обработкой РНКазой на колонке в соответствии с инструкциями производителя. Экстрагированную тотальную РНК дополнительно обрабатывали Turbo DNase (Life Technologies).Для Нозерн-блоттинга 5 мкг каждого образца РНК разделяли на 8% полиакриламидном геле, содержащем 7 М мочевину, при 300 В в течение 140 мин с использованием системы переноса геля (Doppel-Gelsystem Twin L, PerfectBlue). РНК переносили на мембраны Hybond-XL (Amersham Hybond-XL, GE Healthcare) с помощью электроблоттера с приложенным напряжением 50 В в течение 1 ч при 4 ° C (Tank-Elektroblotter Web M, PerfectBlue), сшивая УФ-светом для всего 0,12 Дж (УФ-лампа T8C; 254 нм, 8 Вт), гибридизованные в течение ночи в 17 мл буфера Roti-Hybri-Quick при 42 ° C с 5 мкл меченных концом γ-32P-ATP олигодезоксирибонуклеотидов (таблица S1) и визуализируется с помощью Phosphorimager (Typhoon FLA 7000, GE Healthcare).Изображения геля из повторного эксперимента показаны на рис. S7.
РНК переносили на мембраны Hybond-XL (Amersham Hybond-XL, GE Healthcare) с помощью электроблоттера с приложенным напряжением 50 В в течение 1 ч при 4 ° C (Tank-Elektroblotter Web M, PerfectBlue), сшивая УФ-светом для всего 0,12 Дж (УФ-лампа T8C; 254 нм, 8 Вт), гибридизованные в течение ночи в 17 мл буфера Roti-Hybri-Quick при 42 ° C с 5 мкл меченных концом γ-32P-ATP олигодезоксирибонуклеотидов (таблица S1) и визуализируется с помощью Phosphorimager (Typhoon FLA 7000, GE Healthcare).Изображения геля из повторного эксперимента показаны на рис. S7.
Трансформация плазмиды в
E. coliСокращение кратности рассчитывали как отношение колониеобразующих единиц (КОЕ) для клеток, трансформированных плазмидой матрицы без спейсера, к таковой для клеток, трансформированных плазмидой матрицы CRISPR.
Измерения флуоресценции в
E. coli-кратная репрессия GFP рассчитывалась с использованием средних значений флуоресценции за вычетом флуоресценции E. coli , в которых отсутствует репортерная плазмида GFP, и деление результирующего значения флуоресценции для массива без спейсера на значение флуоресценции для тестируемого массива CRISPR.
coli , в которых отсутствует репортерная плазмида GFP, и деление результирующего значения флуоресценции для массива без спейсера на значение флуоресценции для тестируемого массива CRISPR.
Измерения флуоресценции в дрожжах
Долю GFP-положительных клеток рассчитывали, устанавливая пороговое значение для FL1, так что <0,1% клеток, лишенных crRNA, попадают в GFP-положительный интервал. Сообщаемая фракция - это процент клеток, которые попадают выше порогового значения во всей закрытой популяции.
РНК-зондирование в TXTL
Относительные уровни GFP (% GFP) рассчитывали как отношение значения флуоресценции, деленного на значение, полученное с использованием PtL-nt с той же конструкцией целевого массива.
Блокирование расщепления вне мишени в TXTL
Скорость транскрипции рассчитывали как наклон каждой кривой сигнала флуоресценции от 2,5 до 4,5 часов после добавления плазмиды pCas9-notracr. Процент защиты рассчитывали как отношение скорости транскрипции для массива CRISPR к скорости транскрипции для нецелевого контроля.
Сводка отчетов
Дополнительная информация о дизайне исследования доступна в Сводке отчетов по исследованиям природы, связанной с этой статьей.
Управление ориентацией золотых наностержней внутри плотноупакованных двумерных массивов
Золотые наностержни (AuNR) были собраны в плотноупакованные двумерные (2D) массивы с различной структурой методом Ленгмюра – Блоджетт (LB). Структура двумерных массивов (ширина массивов, площадь поверхности и форма круглых пустот) контролировалась путем изменения приложенного поверхностного давления в желобе LB. Из-за анизотропии формы AuNR наблюдалась как сквозная (EE), так и параллельная (SS) сборка в зависимости от длины цепи полимера полиэтиленгликоля (PEG), функционализированного их поверхностями.PEG с короткой цепью стимулировал сборку SS AuNR, в то время как сборки SS и EE были получены в случае использования PEG с длинной цепью. Численный расчет потенциальной энергии между двумя наностержнями как функции разделения и ориентации дал хорошие прогнозы оптимального расстояния разделения между наностержнями и их ориентации внутри массивов. Из-за выравнивания AuNR внутри массивов оптические измерения решеток показали сильный продольный локализованный поверхностный плазмонный резонанс (LSPR) при возбуждении поляризованным светом вдоль оси большинства стержней.Когда угол поляризации был повернут на 90 градусов, интенсивность высокоэнергетического поперечного пика LSPR увеличивалась. Измеренный спектр LSPR массивов был подтвержден расчетами в дискретном дипольном приближении (DDA), которое использовалось для моделирования как спектра LSPR, так и распределения плазмонного поля.
Из-за выравнивания AuNR внутри массивов оптические измерения решеток показали сильный продольный локализованный поверхностный плазмонный резонанс (LSPR) при возбуждении поляризованным светом вдоль оси большинства стержней.Когда угол поляризации был повернут на 90 градусов, интенсивность высокоэнергетического поперечного пика LSPR увеличивалась. Измеренный спектр LSPR массивов был подтвержден расчетами в дискретном дипольном приближении (DDA), которое использовалось для моделирования как спектра LSPR, так и распределения плазмонного поля.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент. ..
Что-то пошло не так. Попробуйте еще раз?
..
Что-то пошло не так. Попробуйте еще раз?Мультиплексная попарная сборка олигонуклеотидов ДНК, полученных из массива | Исследование нуклеиновых кислот
Аннотация
Хотя стоимость секвенирования ДНК за последнее десятилетие упала на пять порядков, синтез ДНК остается дорогостоящим для многих приложений.Хотя ДНК-микрочипы снизили стоимость синтеза олигонуклеотидов, использование синтезированных массивом олигонуклеотидов на практике ограничено короткой длиной синтеза, высокой частотой ошибок синтеза, низким выходом и проблемами сборки длинных конструкций из сложных пулов. Для решения этих проблем мы разработали протокол для мультиплексной попарной сборки олигонуклеотидов из пулов синтезированных массивом олигонуклеотидов. Чтобы оценить этот метод, мы попытались собрать до 2271 мишени длиной от 192 до 255 оснований, используя пары олигонуклеотидов, синтезированных с помощью массива.В пределах наборов сложности от 131 до 250 целей мы наблюдали безошибочные сборки для 90,5% всех целей. Когда все 2271 мишень были собраны в одной реакции, мы наблюдали безошибочные конструкции для 70,6%. Хотя метод сборки существенно повысил точность до небольшой степени, мы дополнительно повысили точность за счет использования высокопроизводительного протокола Dial-Out PCR, который сочетает секвенирование Illumina с собственным набором уникальных тегов ПЦР для выборочного усиления идеальных сборок из сложных синтетические бассейны.Этот подход имеет широкое применение для сборки ДНК и функциональных экранов с высокой пропускной способностью.
Чтобы оценить этот метод, мы попытались собрать до 2271 мишени длиной от 192 до 255 оснований, используя пары олигонуклеотидов, синтезированных с помощью массива.В пределах наборов сложности от 131 до 250 целей мы наблюдали безошибочные сборки для 90,5% всех целей. Когда все 2271 мишень были собраны в одной реакции, мы наблюдали безошибочные конструкции для 70,6%. Хотя метод сборки существенно повысил точность до небольшой степени, мы дополнительно повысили точность за счет использования высокопроизводительного протокола Dial-Out PCR, который сочетает секвенирование Illumina с собственным набором уникальных тегов ПЦР для выборочного усиления идеальных сборок из сложных синтетические бассейны.Этот подход имеет широкое применение для сборки ДНК и функциональных экранов с высокой пропускной способностью.
ВВЕДЕНИЕ
Традиционно ДНК синтезировали методом твердофазной химии фосфорамидита (1). Колоночный синтез дает до 200-меров с частотой ошибок примерно 1 из 200 нт (2) и выходами от 10 до 100 нмоль на продукт. Синтез ДНК на основе колонок ограничен по производительности 384-луночным планшетом (2), а стоимость олигонуклеотидов составляет от 0,05 до 1,00 долл. США за пар оснований в зависимости от длины и выхода (2–4).Коммерциализация струйной печати нуклеотидов с химическим составом фосфорамидита (5–7) (Agilent) и матрицами электрохимического производства кислоты на основе полупроводников (8) (CustomArray) увеличила производительность и снизила стоимость синтеза олигонуклеотидов. Стоимость этих олигонуклеотидов колеблется в пределах 0,00001–0,001 долл.США / пар нуклеотидов в зависимости от длины, масштаба и платформы (2). Однако эти платформы ограничены короткой длиной синтеза, высокой частотой ошибок синтеза, низким выходом и проблемами сборки длинных конструкций из сложных пулов.
Синтез ДНК на основе колонок ограничен по производительности 384-луночным планшетом (2), а стоимость олигонуклеотидов составляет от 0,05 до 1,00 долл. США за пар оснований в зависимости от длины и выхода (2–4).Коммерциализация струйной печати нуклеотидов с химическим составом фосфорамидита (5–7) (Agilent) и матрицами электрохимического производства кислоты на основе полупроводников (8) (CustomArray) увеличила производительность и снизила стоимость синтеза олигонуклеотидов. Стоимость этих олигонуклеотидов колеблется в пределах 0,00001–0,001 долл.США / пар нуклеотидов в зависимости от длины, масштаба и платформы (2). Однако эти платформы ограничены короткой длиной синтеза, высокой частотой ошибок синтеза, низким выходом и проблемами сборки длинных конструкций из сложных пулов.
Многие методы в последнее время обращаются к высокому уровню ошибок олигонуклеотидов, синтезированных на основе массивов, с компромиссом между стоимостью и точностью. Недорогие методы включают такие белки, как MutS (9,10), полимеразы (11-15) и другие белки, которые связывают и разрезают гетеродуплексы (3,16). Однако, поскольку эти методы основаны на выявлении несовпадений и требуют, чтобы большинство последовательностей были идентичными, они не всегда совместимы со сложными библиотеками (17,18) и, следовательно, должны выполняться после сборки отдельных генов.Кроме того, поскольку эти методы сохраняют частоту ошибок до 1 на 1000 оснований, требуется дальнейший скрининг для подтверждения правильной последовательности. Более современные методы, такие как Dial-Out PCR, основаны на секвенировании ДНК с последующим извлечением конструктов с подтвержденной последовательностью, что позволяет достичь уровня ошибок всего лишь 10 –7 (17–19). Хотя эти методы могут работать со сложными пулами олигонуклеотидов и давать очень низкий уровень ошибок, они являются дорогостоящими, требуют много времени и не всегда восстанавливают целевые молекулы.
Однако, поскольку эти методы основаны на выявлении несовпадений и требуют, чтобы большинство последовательностей были идентичными, они не всегда совместимы со сложными библиотеками (17,18) и, следовательно, должны выполняться после сборки отдельных генов.Кроме того, поскольку эти методы сохраняют частоту ошибок до 1 на 1000 оснований, требуется дальнейший скрининг для подтверждения правильной последовательности. Более современные методы, такие как Dial-Out PCR, основаны на секвенировании ДНК с последующим извлечением конструктов с подтвержденной последовательностью, что позволяет достичь уровня ошибок всего лишь 10 –7 (17–19). Хотя эти методы могут работать со сложными пулами олигонуклеотидов и давать очень низкий уровень ошибок, они являются дорогостоящими, требуют много времени и не всегда восстанавливают целевые молекулы.
Несмотря на высокую частоту ошибок, недорогие пулы олигонуклеотидов, отщепленные от микрочипов, недавно сделали возможным высокопроизводительный анализ функций промотора (20–22) и энхансера (23,24), обеспечивая новое понимание словаря этих регуляторных элементов. Они также использовались для расшифровки роли генетических вариантов в функции белков (25). Однако все эти исследования были ограничены короткой длиной синтеза — около 160 п.н. для CustomArray и 230 п.н. для Agilent.
Они также использовались для расшифровки роли генетических вариантов в функции белков (25). Однако все эти исследования были ограничены короткой длиной синтеза — около 160 п.н. для CustomArray и 230 п.н. для Agilent.
Насколько нам известно, Тиан и др. . был первым, кто выполнил синтез генов из пулов олигонуклеотидов, полученных из массива. Поскольку синтез матрицы обеспечивает выход только 1-10 фмоль на последовательность (26), Tian et al . амплифицировали все олигонуклеотиды с помощью общего набора праймеров. Однако исследование ограничило синтез 21 геном, чтобы обойти высокую частоту ошибок синтеза и проблемы сборки конструкций из сложных пулов (27-30).Чтобы решить эту проблему, Kosuri et al . продемонстрировали преамплификационные подмножества олиго-пула, участвующие в специфических сборках, чтобы уменьшить ложную перекрестную гибридизацию, наблюдаемую в крупномасштабных сборках (3). Исследование основывалось на амплификации фрагментов для каждого гена отдельно, что было успешным, но ограничило сборку 47 генов.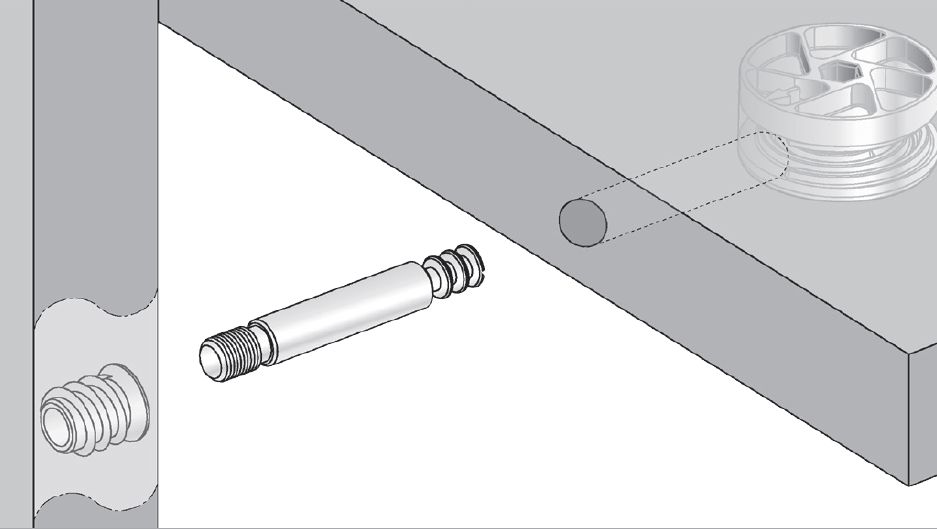 В 2012 году Ким и др. . описали синтез дробовика на 228 олигонуклеотидах, полученных из массива, охватывающих кластер генов биосинтеза пенициллина (19).Подобно Tian et al. ., Ким амплифицировал олигонуклеотиды с помощью универсальных праймеров и удалил последовательности адаптера с помощью двух рестрикционных ферментов. После сборки всех олигонуклеотидов с помощью ПЦР они отобрали фрагменты размером 300–500 п.н. Несмотря на успех, только 3% секвенированных продуктов не содержали ошибок. Чтобы получить безошибочные конструкции, они закодировали и секвенировали свой пул, идентифицируя точные фрагменты, покрывающие 88% их целей. Затем они заказали праймеры, соответствующие штрих-кодам, для извлечения интересующих фрагментов.
В 2012 году Ким и др. . описали синтез дробовика на 228 олигонуклеотидах, полученных из массива, охватывающих кластер генов биосинтеза пенициллина (19).Подобно Tian et al. ., Ким амплифицировал олигонуклеотиды с помощью универсальных праймеров и удалил последовательности адаптера с помощью двух рестрикционных ферментов. После сборки всех олигонуклеотидов с помощью ПЦР они отобрали фрагменты размером 300–500 п.н. Несмотря на успех, только 3% секвенированных продуктов не содержали ошибок. Чтобы получить безошибочные конструкции, они закодировали и секвенировали свой пул, идентифицируя точные фрагменты, покрывающие 88% их целей. Затем они заказали праймеры, соответствующие штрих-кодам, для извлечения интересующих фрагментов.
Короткие длины синтеза и высокая частота ошибок представляют собой узкие места для использования олигонуклеотидов, полученных из массива, как для функциональных анализов, так и для сборки генов. Здесь мы описываем метод сборки тысяч олигонуклеотидов, полученных из массива, в мишени, приближающиеся к оценкам длины цис-регуляторных элементов (31,32) и белковых доменов (33). По сравнению с существующими методами наш метод не ограничивает пространство последовательностей с помощью рестрикционных ферментов, он отличается высокой пропускной способностью и предлагает эффективный способ извлечения безошибочных сборок.
По сравнению с существующими методами наш метод не ограничивает пространство последовательностей с помощью рестрикционных ферментов, он отличается высокой пропускной способностью и предлагает эффективный способ извлечения безошибочных сборок.
МАТЕРИАЛЫ И МЕТОДЫ
Мишени
Целевые последовательности варьируются от 156 до 216 оснований уникальной последовательности и были разделены на 10 наборов. Каждая цель была фрагментирована на две части (A и B) с помощью специального скрипта Python, который определяет перекрытия с наименьшей вероятностью перекрестной гибридизации (см. Дополнительные материалы). Вкратце, мы автоматизировали следующую процедуру с использованием python: основания для области перекрытия динамически добавлялись, начиная с средней точки 7, пока температура плавления не достигла> 56 ° C (34).Затем перекрывающийся фрагмент проверяли по всем последовательностям в наборе и принимали, если <15 последовательных оснований выровнены с любой другой последовательностью. Чтобы быстро оценить выравнивания относительно всех последовательностей в данном наборе, мы использовали простой алгоритм скольжения, который оценивает самые длинные последовательные выравнивания (35). Если перекрывающаяся последовательность не соответствовала этим условиям, мы заменили до 6 кодонов случайным образом в пределах этой области последовательности, и если температура плавления все еще была> 56 ° C, мы повторили этап выравнивания.Если условия по-прежнему не выполнялись, исходное положение для области перекрытия сдвигалось, и процедура повторялась. Было исследовано окно из 6 баз вокруг стартовой позиции. Обычный адаптер длиной 18 п.н. был присоединен к 5′-концу фрагментов A и 3′-концу фрагментов B. Два аденина были присоединены к 3′-концу фрагментов A, а два тимина были присоединены к 5′-концу фрагментов B. Наконец, в зависимости от длины, один или два сайта (-ов) праймеров, специфичных для пула, были добавлены ко всем конструкциям олиго, и случайные основания были добавлены на 3′-стороне, чтобы получить 160 оснований для каждой конструкции олигонуклеотидов (рис.
Чтобы быстро оценить выравнивания относительно всех последовательностей в данном наборе, мы использовали простой алгоритм скольжения, который оценивает самые длинные последовательные выравнивания (35). Если перекрывающаяся последовательность не соответствовала этим условиям, мы заменили до 6 кодонов случайным образом в пределах этой области последовательности, и если температура плавления все еще была> 56 ° C, мы повторили этап выравнивания.Если условия по-прежнему не выполнялись, исходное положение для области перекрытия сдвигалось, и процедура повторялась. Было исследовано окно из 6 баз вокруг стартовой позиции. Обычный адаптер длиной 18 п.н. был присоединен к 5′-концу фрагментов A и 3′-концу фрагментов B. Два аденина были присоединены к 3′-концу фрагментов A, а два тимина были присоединены к 5′-концу фрагментов B. Наконец, в зависимости от длины, один или два сайта (-ов) праймеров, специфичных для пула, были добавлены ко всем конструкциям олиго, и случайные основания были добавлены на 3′-стороне, чтобы получить 160 оснований для каждой конструкции олигонуклеотидов (рис. 1).Затем пулы олигонуклеотидов были синтезированы CustomArray в двух экземплярах, чтобы уменьшить выпадение олигонуклеотидов и повысить однородность.
1).Затем пулы олигонуклеотидов были синтезированы CustomArray в двух экземплярах, чтобы уменьшить выпадение олигонуклеотидов и повысить однородность.
Рисунок 1.
Мультиплексный попарный узел. Всего 2271 мишень была разделена на 10 наборов 131–250 генов. Каждый ген был разделен на фрагменты A и B с перекрывающимися последовательностями, обеспечивающими температуру плавления (Tm)> 56 ° C для ПЦР-опосредованной сборки. Все олигонуклеотиды были отщеплены от матрицы в одну пробирку. Затем мы амплифицировали каждый субпул с одним общим и одним урацил-содержащим пул-специфическим праймером.Затем специфичный для пула праймер удаляли с помощью урацил-специфического иссекающего реагента (USER), а затем с помощью набора New England BioLabs End Repair kit. Во время сборки ПЦР соответствующим субпулам давали возможность отжечь и продлить через 5 циклов ПЦР перед добавлением набора общих внешних праймеров для амплификации. Во время сборки ПЦР последовательности M13F и M13R могут быть введены в конструкции, чтобы обеспечить возможность маркировки исходящих сообщений и извлечения конструкций с подтвержденной последовательностью. В этом исследовании мы собрали до 252-меров из 160-мерных олигонуклеотидов CustomArray.
В этом исследовании мы собрали до 252-меров из 160-мерных олигонуклеотидов CustomArray.
Рисунок 1.
Мультиплексный парный узел. Всего 2271 мишень была разделена на 10 наборов 131–250 генов. Каждый ген был разделен на фрагменты A и B с перекрывающимися последовательностями, обеспечивающими температуру плавления (Tm)> 56 ° C для ПЦР-опосредованной сборки. Все олигонуклеотиды были отщеплены от матрицы в одну пробирку. Затем мы амплифицировали каждый субпул с одним общим и одним урацил-содержащим пул-специфическим праймером. Затем специфичный для пула праймер удаляли с помощью урацил-специфического иссекающего реагента (USER), а затем с помощью набора New England BioLabs End Repair kit.Во время сборки ПЦР соответствующим субпулам давали возможность отжечь и продлить через 5 циклов ПЦР перед добавлением набора общих внешних праймеров для амплификации. Во время сборки ПЦР последовательности M13F и M13R могут быть введены в конструкции, чтобы обеспечить возможность маркировки исходящих сообщений и извлечения конструкций с подтвержденной последовательностью. В этом исследовании мы собрали до 252-меров из 160-мерных олигонуклеотидов CustomArray.
В этом исследовании мы собрали до 252-меров из 160-мерных олигонуклеотидов CustomArray.
Попарная сборка олигонуклеотидов
Цели были разделены на наборы сложности от 131 до 250.Каждый пул фрагментов A и B амплифицировали вне массива с использованием одного общего праймера и одного пул-специфичного праймера, содержащего урацил, с помощью Kapa HiFi HotStart Uracil + Readymix. Количественную ПЦР (qPCR) проводили в 25 мкл реакции с SYBR Green в системе MiniOpticon Real-Time PCR (Bio-Rad) с 2,5 нг матрицы. Каждый пул извлекали из термоциклера за один цикл до выхода на плато, очищали 1,8-кратными гранулами AMPure XP и элюировали 20 мкл. Два микролитра фермента NEB USER смешивали с очищенными пулами ПЦР и инкубировали при 37 ° C в течение 15 минут, а затем 15 минут при комнатной температуре.Затем пулы обрабатывали модулем NEBNext End Repair Module согласно протоколу производителя для удаления последовательностей адаптеров. Пулы очищали и концентрировали в 10 мкл с использованием Zymo DNA Clean and Concentrator.
Пулы очищали и концентрировали в 10 мкл с использованием Zymo DNA Clean and Concentrator.
Соответствующие библиотеки фрагментов A и B были собраны с помощью Kapa Hifi Hotstart Readymix (Kapa Biosystems) с использованием кПЦР с общим количеством 1,5 нг очищенных соответствующих пулов исходной ДНК. После 5 циклов отжига и удлинения добавляли 7,5 × 10 -12 моль каждого внешнего праймера (YF-pu1L и YR-pu1R), и реакцию продолжали в течение дополнительных циклов.За реакциями следили с помощью прибора для количественной ПЦР в реальном времени, и один или несколько циклов прекращались до выхода на плато. Обычно для этого требовалось 20–25 циклов в дополнение к первым 5 циклам. Для обеих фаз использовался следующий протокол: (i) 95 ° C в течение 2 минут, (ii) 98 ° C в течение 20 секунд, (iii) 65 ° C в течение 15 секунд, (iv) 72 ° C в течение 45 секунд, (v) повторить шаги ii – iv. Затем реакционные смеси очищали 1,8x гранулами AMPure XP и элюировали 20 мкл.
Два нанограмма очищенной реакции использовали в другой ПЦР в реальном времени с Kapa HiFi Hotstart Readymix с праймерами Pu1L_Flowcell и Pu1R_Flowcell. Реакции извлекали из циклера за один цикл до выхода на плато, очищали с помощью гранул 1,8x AMPure XP и секвенировали на Illumina MiSeq с парными считываниями на концах 155 п.н. с Pu1_Sequencing_F, Pu1_Sequencing_R и Pu1_Sequencing_I (дополнительная таблица S1). Для сложных наборов, включающих до 2271 мишени, входная ДНК из соответствующих субпулов смешивалась вместе, поддерживая одинаковое общее количество входящей ДНК в 1,5 нг.
Реакции извлекали из циклера за один цикл до выхода на плато, очищали с помощью гранул 1,8x AMPure XP и секвенировали на Illumina MiSeq с парными считываниями на концах 155 п.н. с Pu1_Sequencing_F, Pu1_Sequencing_R и Pu1_Sequencing_I (дополнительная таблица S1). Для сложных наборов, включающих до 2271 мишени, входная ДНК из соответствующих субпулов смешивалась вместе, поддерживая одинаковое общее количество входящей ДНК в 1,5 нг.
Мы создали случайные 13-мерные последовательности и проверили их по нескольким свойствам: отсутствие участков гомогуанина или гомоцитозина> 5 п.н., отсутствие гомоадениновых или гомотиминовых участков> 8 п.н. и содержание GC от 45% до 65%.13-меры, прошедшие этот фильтр, добавляли к потенциальному набору, если последние 10 оснований имели нуклеотидную идентичность <90% с любым другим прямым, обратным, комплементарным или обратным комплементом уже в списке. Этот конвейер был повторен несколько раз, в конечном итоге с 1,2 миллионами итераций, чтобы сгенерировать библиотеку из 7411 13-меров.
Этот конвейер был повторен несколько раз, в конечном итоге с 1,2 миллионами итераций, чтобы сгенерировать библиотеку из 7411 13-меров.
Свободная энергия Гиббса для каждой возможной пары праймеров была рассчитана с использованием Unafold (36) со следующими настройками: –NA = ДНК, –run-type = html, –Ct = 0,000001, –sodium = 0.050, –магний = 0,002. Все 13-мерные пары с dG> -9 ккал / моль были проиндексированы и добавлены в матрицу MatrixMarket Matrix. Затем была идентифицирована максимальная библиотека из 13-меров со всеми попарными dG> -9 ккал / моль с использованием библиотеки параллельных максимальных кликов (arXiv: 1302,6256). Проиндексированные 13-меры были преобразованы обратно в их соответствующие последовательности, и была применена дополнительная стадия для удаления любых праймеров с потенциальными гомодимерами. В результате остался набор из 4637 13-мерных элементов, который был разделен на прямую библиотеку из 2318 тегов и обратную библиотеку из 2319 тегов с общей сложностью тегов 5 444 982 (рис. 2).
2).
Рисунок 2.
Конвейер для генерации библиотеки статических тегов. Мы сгенерировали 1,2 миллиона случайных 13-меров и проверили их на отсутствие гомогуанина или гомоцитозина более 5 п.н., отсутствия гомоаденина или гомотимина более 8 п.о. и содержания GC от 45% до 65%. Мы также проверили идентичность нуклеотидов <90% в последних 10 п.н., в результате чего был получен набор из 7411 13-меров. Из этого набора из 7411 последовательностей мы рассчитали каждую попарную свободную энергию Гиббса и определили максимальное количество последовательностей, при которых ни один из двух членов не имел dG ≤ -9 ккал / моль.В результате остался набор из 4637 последовательностей, которые были разделены на набор из 2318 прямых тегов и 2319 обратных тегов.
Рисунок 2.
Конвейер для генерации библиотеки статических тегов. Мы сгенерировали 1,2 миллиона случайных 13-меров и проверили их на отсутствие гомогуанина или гомоцитозина более 5 п.н., отсутствия гомоаденина или гомотимина более 8 п. о. и содержания GC от 45% до 65%. Мы также проверили идентичность нуклеотидов <90% в последних 10 п.н., в результате чего был получен набор из 7411 13-меров. Из этого набора из 7411 последовательностей мы рассчитали каждую попарную свободную энергию Гиббса и определили максимальное количество последовательностей, при которых ни один из двух членов не имел dG ≤ -9 ккал / моль.В результате остался набор из 4637 последовательностей, которые были разделены на набор из 2318 прямых тегов и 2319 обратных тегов.
о. и содержания GC от 45% до 65%. Мы также проверили идентичность нуклеотидов <90% в последних 10 п.н., в результате чего был получен набор из 7411 13-меров. Из этого набора из 7411 последовательностей мы рассчитали каждую попарную свободную энергию Гиббса и определили максимальное количество последовательностей, при которых ни один из двух членов не имел dG ≤ -9 ккал / моль.В результате остался набор из 4637 последовательностей, которые были разделены на набор из 2318 прямых тегов и 2319 обратных тегов.
К передним 13-мерам 5′-CGACAGTAACTACACGGCGA-3 ‘был добавлен к 5′-концу в качестве моста для адаптера проточной кюветы, а M13 (5′-GTTTTCCCAGTCACGAC-3′) был добавлен к 3′-концу. как исходную последовательность Dial-Out. В противоположность 13-мерам, 5’-GTAGCAATTGGCAGGTCCAT-3 ‘использовали в качестве мостика, а M13R (5′-CAGGAAACAGCTATGAC-3’) использовали в качестве затравочной последовательности.
Разработка и синтез праймеров для исходящего извлечения
Для каждого 13-мера Tm была рассчитана с использованием | $ T _ {\ rm m} = 81. +] + 41 \ times ({\ rm GC}) — \ frac {{600}} {n} $ | (37). Последовательности праймеров определяли путем рекурсивного добавления 2 п.н. от мостиковой последовательности к 5′-концу праймера до тех пор, пока Tm не станет между 58 ° C и 61 ° C. После этой процедуры все праймеры имели длину 17 или 19 нуклеотидов с Tm между 58,2 ° C и 60,6 ° C. Праймеры были заказаны в IDT в формате 96-луночного планшета со стандартным обессоливанием.
+] + 41 \ times ({\ rm GC}) — \ frac {{600}} {n} $ | (37). Последовательности праймеров определяли путем рекурсивного добавления 2 п.н. от мостиковой последовательности к 5′-концу праймера до тех пор, пока Tm не станет между 58 ° C и 61 ° C. После этой процедуры все праймеры имели длину 17 или 19 нуклеотидов с Tm между 58,2 ° C и 60,6 ° C. Праймеры были заказаны в IDT в формате 96-луночного планшета со стандартным обессоливанием.
Синтез и подготовка библиотеки статических тегов
Метки 4637 были синтезированы с использованием электрохимического процесса полупроводников CustomArray в двух экземплярах.Наборы прямых и обратных тегов амплифицировали в 24 параллельных реакциях по 50 мкл из 1,25 × 10 -14 моль матрицы / реакция с использованием FP: 5′- CGACAGTAACTACACGGCGA -3 ‘и RP: 5′- GTCGTGACTGGGAAAAC -3’ с Kapa Hifi Hotstart Readymix на 17 циклов. Десять наномолярных продуктов ПЦР расщепляли экзонуклеазой лямбда NEB в соответствии с протоколом производителя. Образец 113 нг смешивали с эквивалентным объемом буфера для образцов мочевины Novex TBE и нагревали при 70 ° C в течение 3 минут, затем охлаждали на льду. Образцы и лестницу обрабатывали на геле мочевины Novex TBE, и соответствующую полосу 50 п.н. разрезали.Полосы нарезали кубиками и центрифугировали через 600 мл Eppendorf с отверстием для иглы 22 калибра. Суспензии инкубировали с буфером ТЕ при 65 ° C в течение 2 ч и очищали на колонке Spin-X (Corning). Очищенную ДНК обрабатывали набором для удаления нуклеотидов Qiagen согласно протоколу производителя.
Образец 113 нг смешивали с эквивалентным объемом буфера для образцов мочевины Novex TBE и нагревали при 70 ° C в течение 3 минут, затем охлаждали на льду. Образцы и лестницу обрабатывали на геле мочевины Novex TBE, и соответствующую полосу 50 п.н. разрезали.Полосы нарезали кубиками и центрифугировали через 600 мл Eppendorf с отверстием для иглы 22 калибра. Суспензии инкубировали с буфером ТЕ при 65 ° C в течение 2 ч и очищали на колонке Spin-X (Corning). Очищенную ДНК обрабатывали набором для удаления нуклеотидов Qiagen согласно протоколу производителя.
Маркировка собранных мишеней
Несколько концентраций меток и входных данных были протестированы для оптимального мечения с несколькими различными полимеразами (дополнительная таблица S2). Мы определили, что 8.5 × 10 −14 молей меток с входом 3 нг (молекулярное соотношение метка: входной сигнал 10: 1) с помощью Kapa HiFi HotStart Readymix обеспечили оптимальную производительность. В процессе сборки мы амплифицировали мишени с праймерами, содержащими M13F и M13R, следуя описанному выше протоколу сборки. Библиотеки очищали с помощью шариков 1,8x AMPure XP и элюировали 20 мкл. Три нанограмма очищенной библиотеки сборки были помечены 8,5 × 10 -14 молей исходящих тегов (исходящие теги F и исходящие теги R) с использованием Kapa HiFi HotStart Readymix с использованием qPCR и следующих условий цикла: (i ) 95 ° C в течение 2 минут, (ii) 98 ° C в течение 20 секунд, (iii) 65 ° C в течение 15 секунд, (iv) 72 ° C в течение 45 секунд, (v) повторить шаги ii – iv 30 раз и ( vi) 72 ° C в течение 5 минут и (vi) 72 ° C в течение 5 минут.После первых 5 циклов реакцию приостанавливали и добавляли 1,5 × 10 -11 моль штрих-кодированных праймеров для прямого и обратного проточных клеток (Dial-Out_Flow_Cell_F и Dial-Out_Flow_Cell_R). Помеченные библиотеки удаляли из циклера за один цикл до выхода на плато и очищали с использованием 1,8-кратных гранул AMPure XP.
В процессе сборки мы амплифицировали мишени с праймерами, содержащими M13F и M13R, следуя описанному выше протоколу сборки. Библиотеки очищали с помощью шариков 1,8x AMPure XP и элюировали 20 мкл. Три нанограмма очищенной библиотеки сборки были помечены 8,5 × 10 -14 молей исходящих тегов (исходящие теги F и исходящие теги R) с использованием Kapa HiFi HotStart Readymix с использованием qPCR и следующих условий цикла: (i ) 95 ° C в течение 2 минут, (ii) 98 ° C в течение 20 секунд, (iii) 65 ° C в течение 15 секунд, (iv) 72 ° C в течение 45 секунд, (v) повторить шаги ii – iv 30 раз и ( vi) 72 ° C в течение 5 минут и (vi) 72 ° C в течение 5 минут.После первых 5 циклов реакцию приостанавливали и добавляли 1,5 × 10 -11 моль штрих-кодированных праймеров для прямого и обратного проточных клеток (Dial-Out_Flow_Cell_F и Dial-Out_Flow_Cell_R). Помеченные библиотеки удаляли из циклера за один цикл до выхода на плато и очищали с использованием 1,8-кратных гранул AMPure XP.
Проверка последовательности исходящих тегированных целей
Меченую библиотеку секвенировали на Illumina MiSeq со считыванием PE 155 п. н. с использованием праймеров Dial-Out_Sequencing_F, Dial-Out_Sequencing_R и Dial-Out_Sequencing_I.Чтения были объединены с PEAR с использованием настроек по умолчанию, и были идентифицированы пары тегов для всех чтений (38). Используя собственный скрипт Python (дополнительный файл), мы идентифицировали все чтения, содержащие конструкции с проверенной последовательностью, и соответствующие им пары тегов. Для поиска случайным образом была выбрана одна правильно собранная молекула на мишень, отвечающую следующим критериям: (i) содержащая уникальный набор меток, не идентифицированных ни на одной другой молекуле, и (ii) представленная как минимум в 5 считываниях секвенирования.
н. с использованием праймеров Dial-Out_Sequencing_F, Dial-Out_Sequencing_R и Dial-Out_Sequencing_I.Чтения были объединены с PEAR с использованием настроек по умолчанию, и были идентифицированы пары тегов для всех чтений (38). Используя собственный скрипт Python (дополнительный файл), мы идентифицировали все чтения, содержащие конструкции с проверенной последовательностью, и соответствующие им пары тегов. Для поиска случайным образом была выбрана одна правильно собранная молекула на мишень, отвечающую следующим критериям: (i) содержащая уникальный набор меток, не идентифицированных ни на одной другой молекуле, и (ii) представленная как минимум в 5 считываниях секвенирования.
Поиск исходящего вызова
Выбранные олигонуклеотиды были извлечены с помощью ПЦР с помощью Kapa HiFi Hotstart Readymix с использованием ПЦР в реальном времени с 0.135 нг матрицы и 1,5 × 10 −11 моль каждого из соответствующих праймеров прямого и обратного обратного извлечения при следующих условиях: (i) 95 ° C в течение 3 минут, (ii) 98 ° C в течение 20 с, ( iii) 65 ° C в течение 15 с, (iv) 72 ° C в течение 40 с, (v) повторить шаги ii – iv 34 раза и (vi) 72 ° C в течение 5 минут. Реакции удаляли из циклера непосредственно перед выходом на плато, очищали с помощью 1,8x Ampure и количественно оценивали с помощью Qubit (Invitrogen). Для секвенирования были смешаны равные концентрации каждой реакции извлечения.
Реакции удаляли из циклера непосредственно перед выходом на плато, очищали с помощью 1,8x Ampure и количественно оценивали с помощью Qubit (Invitrogen). Для секвенирования были смешаны равные концентрации каждой реакции извлечения.
Анализ средней нуклеотидной точности
Все чтения секвенирования были сопоставлены со ссылкой на предполагаемые целевые последовательности с использованием BWA v.0.7.3. Средняя нуклеотидная точность рассчитывалась для оснований с выровненными считываниями с основанием и оценкой картирования качества> 20. Чтобы сравнить показатели точности между экспериментами, мы проанализировали частоту ошибок для набора 5 до и после сборки. Мы выполнили точные тесты Пуассона для 15 935 028 оснований собранного набора и 9 325 493 оснований соответствующих пулов олигонуклеотидов, соответствующих нашим критериям качества. Мы также провели тест на 1 546 665 основаниях перекрывающейся области в собранном наборе и 1 617 760 основаниях в пулах олигонуклеотидов.
РЕЗУЛЬТАТЫ
Наборы мишеней 131–250
Мы разработали in silico 2271 мишень в диапазоне 192–252 оснований (156–216 уникальных последовательностей) для сборки из олигонуклеотидов, полученных из массива. Все мишени состояли из уникальной последовательности, фланкированной одними и теми же общими адаптерами из 18 п.н. 5 ‘и 3’. Каждая целевая последовательность была разделена на два фрагмента, A и B, содержащих перекрывающуюся область с Tm> 56 ° C. 2271 последовательность-мишень была разделена на 10 наборов 131–250 мишеней, и каждый набор получил уникальные адаптеры, фланкирующие 3′-конец фрагментов A и 5′-конец фрагментов B, предназначенных для включения урацила (рис. 1).Соответствующие олигонуклеотиды (160-мерные с буферной последовательностью) были синтезированы CustomArray в двух экземплярах для уменьшения выпадения олигонуклеотидов и повышения однородности.
Сначала мы амплифицировали каждый пул олигонуклеотидов из массива с праймером, специфичным для субпула (фрагмент uniqueF или фрагмент B uniqueR) на одном конце и общим праймером (YF / YR) на другом (дополнительная таблица S1). Секвенирование библиотеки олигонуклеотидов показало хорошую однородность с межквартильным размахом 5,5 (рис. 3А).
Рисунок 3.
Сборка мишеней в наборы 131–250. ( A ) График однородности безошибочных олигонуклеотидов, полученных из массива, по упорядоченному процентилю для всех 2271 мишеней. ( B ) Количество и размер целей, а также безошибочный выход для каждого набора целей. ( C ) Каждая цель помещается в ячейку на основе ограничивающего числа олигонуклеотидов, которое представляет собой количество безошибочных считываний из 1,2 миллиона, ограниченных для соответствующей цели. % Доходность сборок — это процент целевых объектов в этом отсеке с хотя бы одной идеальной сборкой.( D ) Процент совершенных, только несоответствующих, малых отступов (<5 п. н.), больших отступов (≥5 п.н.), усечений и несопоставленных считываний для всех олигонуклеотидов. ( E ) Процент совершенных, только несоответствующих, малых отступов (<5 п.н.), больших отступов (≥5 п.н.), химер, усечений и несопоставленных чтений для каждой собранной библиотеки. ( F ) Единообразие каждого набора целей. Обратите внимание, что набор 10 содержит только 131 цель.
Рисунок 3.
Сборка мишеней наборами 131–250. ( A ) График однородности безошибочных олигонуклеотидов, полученных из массива, по упорядоченному процентилю для всех 2271 мишеней.( B ) Количество и размер целей, а также безошибочный выход для каждого набора целей. ( C ) Каждая цель помещается в ячейку на основе ограничивающего числа олигонуклеотидов, которое представляет собой количество безошибочных считываний из 1,2 миллиона, ограниченных для соответствующей цели. % Доходность сборок — это процент целевых объектов в этом отсеке с хотя бы одной идеальной сборкой.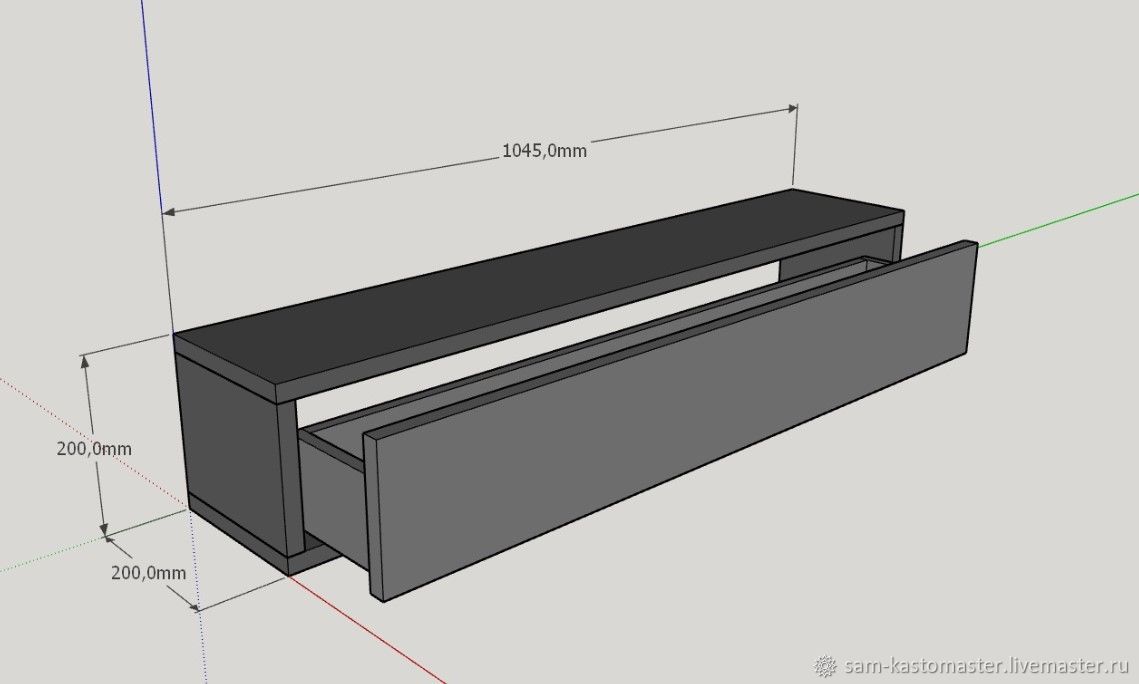 ( D ) Процент совершенных, только несоответствующих, малых отступов (<5 п.н.), больших отступов (≥5 п.н.), усечений и несопоставленных считываний для всех олигонуклеотидов.( E ) Процент совершенных, только несоответствующих, малых отступов (<5 п.н.), больших отступов (≥5 п.н.), химер, усечений и несопоставленных чтений для каждой собранной библиотеки. ( F ) Единообразие каждого набора целей. Обратите внимание, что набор 10 содержит только 131 цель.
( D ) Процент совершенных, только несоответствующих, малых отступов (<5 п.н.), больших отступов (≥5 п.н.), усечений и несопоставленных считываний для всех олигонуклеотидов.( E ) Процент совершенных, только несоответствующих, малых отступов (<5 п.н.), больших отступов (≥5 п.н.), химер, усечений и несопоставленных чтений для каждой собранной библиотеки. ( F ) Единообразие каждого набора целей. Обратите внимание, что набор 10 содержит только 131 цель.
Олиго-пулы, предоставленные CustomArray, затем амплифицировали с использованием праймера для фрагмента A, содержащего урацил, и праймера YF или праймера для фрагмента B, содержащего урацил, и YR (дополнительная таблица S1), и соответствующие специфические адаптеры удаляли с помощью реагента для удаления урацила (USER ).Для двух пулов мы тестировали амплифицирующие олигонуклеотиды с одним или двумя уникальными праймерными сайтами и не наблюдали разницы в составе сборки или однородности (дополнительный рисунок S1). Соответствующие фрагменты A и B были смешаны для каждого набора мишеней и собраны через 5 циклов отжига с удлинением и приблизительно 25 циклов амплификации с помощью Kapa HiFi. Во всех случаях наблюдалась полоса правильного размера. Каждый собранный набор был закодирован и упорядочен.
Соответствующие фрагменты A и B были смешаны для каждого набора мишеней и собраны через 5 циклов отжига с удлинением и приблизительно 25 циклов амплификации с помощью Kapa HiFi. Во всех случаях наблюдалась полоса правильного размера. Каждый собранный набор был закодирован и упорядочен.
Для каждого набора мы выявили безошибочно собранные конструкции для 72.7–96,4% целей при глубине секвенирования 90 000 считываний (рис. 3B). Для каждой цели мы проверили количество безошибочных чтений для соответствующих олигонуклеотидов A и B (из 1,2 миллиона чтений). Из 223 мишеней без идентифицированных безошибочных сборок 55 (24,7%) попали в нижний 10-й процентиль предельной концентрации олигонуклеотидов (<6 безошибочных считываний из 1,2 миллиона), а 97 (43,5%) попали в нижний 20-й процентиль. процентиль предельного числа олигонуклеотидов (<11 безошибочных считываний из 1,2 миллиона). На рис. 3C показан более высокий выход (% мишеней, по крайней мере, с одной идеальной собранной последовательностью) для мишеней, собранных из более представленных ограничивающих олигонуклеотидов в пуле массива, предполагая, что увеличение однородности олигонуклеотидов, вероятно, улучшит выход полноразмерных дизайнов. Затем мы рассмотрели состав пулов сырых олигонуклеотидов и собранных целевых библиотек (рис. 3D и E). В общей сложности 23,8% молекул представляли собой безошибочные сборки, 36,2% содержали сборки без инделей и 53,4% содержали небольшие индели (<5 п.н.). Еще 2,3% содержали большие индели (> 5 п.н.), 4,8% содержали химеры, 2,1% содержали укороченные конструкции и 0,6% считываний без картирования. В каждом наборе 6 из 10 наборов имели <15-кратную разницу в межквартильном размахе. Хотя это может быть проблемой для некоторых приложений, однородность достаточно высока, чтобы использовать наборы непосредственно для некоторых последующих приложений скрининга, таких как функциональные белковые скрининги.Графики однородности показаны на рисунке 3F.
Из 2271 мишеней, синтезированных в отдельные наборы, мы собрали безошибочные конструкции для 2055 (90,5%). Большая часть выпадения, по-видимому, связана с плохим представлением соответствующих олигонуклеотидов в пуле массива (рис. 3C). Кроме того, большинство ошибок, выявленных в собранных наборах, вероятно, связано с синтезом массива, поскольку аналогичные профили ошибок идентифицируются в пулах олигонуклеотидов (рис. 3D и E). Химерная сборка (сборка неправильных фрагментов A и B) встречается редко.
3D и E). Химерная сборка (сборка неправильных фрагментов A и B) встречается редко.
Мультиплексная сборка из 2271 пары фрагментов
Чтобы проверить ограничения нашего протокола сборки, мы увеличили сложность, добавляя по одному дополнительному набору за раз, до 2271 конструкции. При сложности 2271 мы собрали безошибочные конструкции для 70,6% целей при глубине секвенирования 300 000 чтений (рис. 4A и B). Мы наблюдали еще большую корреляцию между выходом и представлением ограничивающего олиго в пуле массива по сравнению с меньшими наборами (рис. 4C).
Рисунок 4.
Влияние сложности на производительность сборки. ( A ) Процент целей с хотя бы одной безошибочной сборкой для каждого уровня сложности. ( B ) Доходность (количество целей с хотя бы одним точным считыванием) в зависимости от сложности. Красные столбцы показывают общее количество целей с безошибочными сборками на каждом уровне сложности. Черные полосы показывают количество мишеней из соответствующих наборов с безошибочной сборкой, которые были индивидуально собраны в наборы сложности от 131 до 250.( C ) Каждая цель помещается в корзину на основе предельного числа олигонуклеотидов, которое представляет собой количество безошибочных считываний (из 1,2 миллиона), которые ограничивают ее соответствующую цель.% Доходности сборок — это процент мишеней в этом бункере с хотя бы одной идеальной сборкой. ( D ) Процент идеальных, только несоответствующих, мелких отступов (<5 пар оснований), больших отступов (≥5 пар оснований), химер, усечений и несопоставленных считываний в наборах возрастающей сложности. ( E ) Единообразие каждого набора целей.
Черные полосы показывают количество мишеней из соответствующих наборов с безошибочной сборкой, которые были индивидуально собраны в наборы сложности от 131 до 250.( C ) Каждая цель помещается в корзину на основе предельного числа олигонуклеотидов, которое представляет собой количество безошибочных считываний (из 1,2 миллиона), которые ограничивают ее соответствующую цель.% Доходности сборок — это процент мишеней в этом бункере с хотя бы одной идеальной сборкой. ( D ) Процент идеальных, только несоответствующих, мелких отступов (<5 пар оснований), больших отступов (≥5 пар оснований), химер, усечений и несопоставленных считываний в наборах возрастающей сложности. ( E ) Единообразие каждого набора целей.
Рисунок 4.
Влияние сложности на производительность сборки. ( A ) Процент целей с хотя бы одной безошибочной сборкой для каждого уровня сложности. ( B ) Доходность (количество целей с хотя бы одним точным считыванием) в зависимости от сложности. Красные столбцы показывают общее количество целей с безошибочными сборками на каждом уровне сложности. Черные полосы показывают количество мишеней из соответствующих наборов с безошибочной сборкой, которые были индивидуально собраны в наборы сложности от 131 до 250.( C ) Каждая цель помещается в корзину на основе предельного числа олигонуклеотидов, которое представляет собой количество безошибочных считываний (из 1,2 миллиона), которые ограничивают ее соответствующую цель.% Доходности сборок — это процент мишеней в этом бункере с хотя бы одной идеальной сборкой. ( D ) Процент идеальных, только несоответствующих, мелких отступов (<5 пар оснований), больших отступов (≥5 пар оснований), химер, усечений и несопоставленных считываний в наборах возрастающей сложности. ( E ) Единообразие каждого набора целей.
Красные столбцы показывают общее количество целей с безошибочными сборками на каждом уровне сложности. Черные полосы показывают количество мишеней из соответствующих наборов с безошибочной сборкой, которые были индивидуально собраны в наборы сложности от 131 до 250.( C ) Каждая цель помещается в корзину на основе предельного числа олигонуклеотидов, которое представляет собой количество безошибочных считываний (из 1,2 миллиона), которые ограничивают ее соответствующую цель.% Доходности сборок — это процент мишеней в этом бункере с хотя бы одной идеальной сборкой. ( D ) Процент идеальных, только несоответствующих, мелких отступов (<5 пар оснований), больших отступов (≥5 пар оснований), химер, усечений и несопоставленных считываний в наборах возрастающей сложности. ( E ) Единообразие каждого набора целей.
Нас также интересовало, повлияет ли возрастающая сложность на состав собираемых библиотек. Хотя два набора с наименьшей сложностью (250 и 462 цели) показывают самый высокий процент идеального чтения и чтения без отступов, это, вероятно, связано с тем, что эти два набора состоят из наборов 2 и 3, которые по отдельности показали высокий процент идеального чтения. и чтения без индексов (рис. 3E). Все остальные библиотеки имеют похожие композиции. Для всех уровней сложности 11,8–31.3% прочтений представляли идеальные конструкции, 10,0–18,7% представляли конструкции только с несовпадениями, 41,4–48,5% представляли мелкие индели, 2,6–3,5% представляли большие индели, 3,7–21,5% представляли химеры, 2,5–4,9% представляли усечения и 0,1– 0,7% несопоставленных считываний (рис. 4D). В каждом наборе разница в межквартильном размахе составляла от 10 до 34 раз. Графики однородности показаны на рисунке 4E.
и чтения без индексов (рис. 3E). Все остальные библиотеки имеют похожие композиции. Для всех уровней сложности 11,8–31.3% прочтений представляли идеальные конструкции, 10,0–18,7% представляли конструкции только с несовпадениями, 41,4–48,5% представляли мелкие индели, 2,6–3,5% представляли большие индели, 3,7–21,5% представляли химеры, 2,5–4,9% представляли усечения и 0,1– 0,7% несопоставленных считываний (рис. 4D). В каждом наборе разница в межквартильном размахе составляла от 10 до 34 раз. Графики однородности показаны на рисунке 4E.
Исправление ошибок собранных мишеней
пулов олигонуклеотидов секвенировали и сравнивали с эталоном предполагаемых целевых последовательностей.Для анализа ошибок мы решили изучить один набор из 250 целей, каждая по 237 оснований (набор 5). Мы рассчитали среднюю нуклеотидную точность для оснований с выровненными считываниями, имеющими оценку качества сопоставления> 20. Мы определили среднюю нуклеотидную точность олигонуклеотидов 98,68% после амплификации вне массива. Поскольку наш процесс сборки зависит от двух участков прайминга и области перекрытия, мы предположили, что сборка может существенно повысить точность в этих областях. Действительно, мы обнаружили, что средняя нуклеотидная точность всех выравнивающих молекул в реакции 250-сплетений составляет 99.02% (коэффициент Пуассона 95% ДИ 1,36–1,38), демонстрируя наивысшую точность вокруг двух участков прайминга и области перекрытия (рис. 5А). В частности, средняя точность нуклеотидов для перекрывающейся области увеличилась с 98,53 до 99,44% (коэффициент Пуассона 95% ДИ 2,64–2,77).
Поскольку наш процесс сборки зависит от двух участков прайминга и области перекрытия, мы предположили, что сборка может существенно повысить точность в этих областях. Действительно, мы обнаружили, что средняя нуклеотидная точность всех выравнивающих молекул в реакции 250-сплетений составляет 99.02% (коэффициент Пуассона 95% ДИ 1,36–1,38), демонстрируя наивысшую точность вокруг двух участков прайминга и области перекрытия (рис. 5А). В частности, средняя точность нуклеотидов для перекрывающейся области увеличилась с 98,53 до 99,44% (коэффициент Пуассона 95% ДИ 2,64–2,77).
Рисунок 5.
Исправление ошибок собранных конструкций. ( A ) Базовая точность собранных конструкций в черном цвете и соответствующих им олигонуклеотидов в красном и синем. Повышенная точность наблюдается как на сайтах прайминга, так и в области перекрытия.( B ) Столбчатые диаграммы для процента тегов, идентифицированных только на одной, двух, трех, четырех или по крайней мере 5 различных молекулах в секвенированной библиотеке. Оранжевая и пурпурная полоски — это два разных сборочных набора, в каждом по 250 мишеней. ( C ) Процент операций чтения, не содержащих ошибок, для каждой из 25 извлеченных сборок.
Оранжевая и пурпурная полоски — это два разных сборочных набора, в каждом по 250 мишеней. ( C ) Процент операций чтения, не содержащих ошибок, для каждой из 25 извлеченных сборок.
Рисунок 5.
Исправление ошибок собранных конструкций. ( A ) Базовая точность собранных конструкций в черном цвете и соответствующих им олигонуклеотидов в красном и синем.Повышенная точность наблюдается как на сайтах прайминга, так и в области перекрытия. ( B ) Столбчатые диаграммы для процента тегов, идентифицированных только на одной, двух, трех, четырех или по крайней мере 5 различных молекулах в секвенированной библиотеке. Оранжевая и пурпурная полоски — это два разных сборочных набора, в каждом по 250 мишеней. ( C ) Процент операций чтения, не содержащих ошибок, для каждой из 25 извлеченных сборок.
Пока мы видим значительное повышение точности на уровне нуклеотидов ( P ∼4.9e-324), мы все еще были ограничены максимумом 37% совершенных считываний в собранном наборе. Для последующих приложений, полагающихся на точные молекулы, таких как сборка генов, мы были заинтересованы в получении идеальных сборок из наших собранных наборов. Для этого мы модифицировали протокол Dial-Out PCR (17), чтобы включить в него набор внутренних статических тегов Dial-Out, чтобы обеспечить рентабельное получение с помощью ПЦР конструкций с подтвержденной последовательностью.
Для последующих приложений, полагающихся на точные молекулы, таких как сборка генов, мы были заинтересованы в получении идеальных сборок из наших собранных наборов. Для этого мы модифицировали протокол Dial-Out PCR (17), чтобы включить в него набор внутренних статических тегов Dial-Out, чтобы обеспечить рентабельное получение с помощью ПЦР конструкций с подтвержденной последовательностью.
Мы разработали праймеры, которые присоединяют M13F и M13R во время реакции сборки для мишеней из наборов 2 и 6 (каждые 250 мишеней).Затем собранные библиотеки были помечены статическими тегами Dial-Out и упорядочены для проверки. Сначала мы проанализировали распределение пар тегов и обнаружили, что 84,0% и 85,6% всех молекул в собранных и помеченных наборах 2 и 6 содержат уникальную, извлекаемую пару тегов (из 1,3 миллиона считываний для набора 2 и 1,6 миллиона считываний для набора 6) (Рисунок 5B). 98,4% и 95,6% мишеней имели сборку с подтвержденной последовательностью и уникальной парой тегов.
Из набора 2 мы выбрали 25 целей для извлечения, каждая из которых была представлена как минимум в 5 из 1.3 миллиона прочтений. Все 25 целей были усилены, и мы оценили точность поиска, объединив все 25 реакций поиска вместе и секвенировав их с 1 миллионом считываний. Все 25 мишеней были секвенированы от 8600 до 62 000 раз, что выявило безошибочные считывания до предела обнаружения химии секвенирования Illumina, которая является более количественной, чем секвенирование по Сэнгеру (рис. 5C). В общей сложности 78% всех считываний секвенирования совпадают с одной из 25 целей. При сопоставлении со всеми 2271 потенциальными мишенями> 99% считываний выровнены, что свидетельствует о некоторой фоновой амплификации сборок с низким содержанием, которые мы не наблюдали в нашем секвенировании, но которые, как оказалось, имеют одинаковые комбинации исходных праймеров.В соответствии с этим секвенирование по Сэнгеру выявило чистые трассы для 22 из 25 целей, но высокие уровни шума для трех трасс (дополнительный рисунок S2).
ОБСУЖДЕНИЕ
Мы стремились разработать протокол для преодоления ограничений олигонуклеотидов, полученных из массива, для создания библиотек и сборки генов. Наш метод основан на мультиплексной попарной сборке и молекулярной маркировке Dial-Out. С помощью этого метода были получены индивидуально извлекаемые 192–252-меры с подтвержденной последовательностью из олигонуклеотидов CustomArray.
Мы протестировали мультиплексную попарную сборку в наборах 131–2271. В дополнение к идеальным последовательностям, состав собранных наборов состоял в основном из небольших инделей и несовпадений, подобно пулам олигонуклеотидов, полученных из необработанных массивов. Состав наборов не изменился заметно со сложностью, превышающей 712 целей, предполагая, что увеличение количества целей на реакцию не сильно меняет количество получаемых химер или сборок, содержащих ошибки. Хотя мы наблюдали снижение урожайности с увеличением сложности, мы все же смогли собрать 70 штук. 6% всех мишеней в реакции 2271 сплетения. Распараллеливая реакции аналогичной сложности в 96-луночном планшете, мы теоретически могли собрать набор из 200 000 конструкций с выходом 70%. Если эксперимент основан на представлении всех целей, наши данные предполагают, что однородность можно улучшить, выполняя сборку наборами по 250 штук, чтобы достичь выхода> 90%.
6% всех мишеней в реакции 2271 сплетения. Распараллеливая реакции аналогичной сложности в 96-луночном планшете, мы теоретически могли собрать набор из 200 000 конструкций с выходом 70%. Если эксперимент основан на представлении всех целей, наши данные предполагают, что однородность можно улучшить, выполняя сборку наборами по 250 штук, чтобы достичь выхода> 90%.
Основными ограничениями в нашем протоколе в настоящее время являются относительно высокая частота ошибок синтеза ДНК (например, несовпадения и дефекты), умеренная частота ошибок сборки ДНК (например.грамм. химеры) и низкая однородность. Низкая однородность входных олигонуклеотидов ухудшает однородность целевых объектов в собранных наборах. Это видно на рисунке 4C, а также на отдельном массиве, в котором олигонуклеотиды не дублировались (дополнительный рисунок S3). Поэтому мы предлагаем, чтобы для увеличения выхода и однородности все олигонуклеотиды дублировались во время синтеза.
Функциональные грохоты с высокой пропускной способностью выиграют от высокоточной и единообразной сборки. Однако во многих приложениях содержащие ошибки молекулы могут быть отфильтрованы на этапе анализа или могут обеспечить дополнительное разнообразие для направленной эволюции.Разброс однородности также можно учесть с помощью апостериорного анализа путем нормализации выборки после отбора к выборке до отбора. Для сборки генов, требующей очень высокой точности, мы реализовали Dial-Out PCR, чтобы выделить идеальные последовательности генов. Однако для иерархической сборки возникает проблема yield, поскольку каждый фрагмент должен быть представлен для сборки более крупных конструкций. В приложениях для иерархической сборки генов конструкции должны быть собраны в меньшие наборы, так как мы можем достичь выхода до 96% в наборах по 250.
Однако во многих приложениях содержащие ошибки молекулы могут быть отфильтрованы на этапе анализа или могут обеспечить дополнительное разнообразие для направленной эволюции.Разброс однородности также можно учесть с помощью апостериорного анализа путем нормализации выборки после отбора к выборке до отбора. Для сборки генов, требующей очень высокой точности, мы реализовали Dial-Out PCR, чтобы выделить идеальные последовательности генов. Однако для иерархической сборки возникает проблема yield, поскольку каждый фрагмент должен быть представлен для сборки более крупных конструкций. В приложениях для иерархической сборки генов конструкции должны быть собраны в меньшие наборы, так как мы можем достичь выхода до 96% в наборах по 250.
Мы полагаем, что, за исключением химер, как высокая частота ошибок, так и отсутствие единообразия обусловлены нашими исходными реагентами, а не протоколом мультиплексной попарной сборки. Профили ошибок собранных наборов точно совпадают с профилем необработанных олигонуклеотидов (рис. 3). Фактически, мы увидели повышение точности на участках заливки и сборки в соответствии с нашим протоколом сборки. Более того, мы собрали по крайней мере одну безошибочную последовательность для каждой мишени с высоким представлением обоих олигонуклеотидов, предполагая, что большая часть проблем с выпадением и однородностью связана с плохой однородностью в синтезе массива.Следовательно, использование более точного и однородного массива также должно уменьшить эти ограничения.
3). Фактически, мы увидели повышение точности на участках заливки и сборки в соответствии с нашим протоколом сборки. Более того, мы собрали по крайней мере одну безошибочную последовательность для каждой мишени с высоким представлением обоих олигонуклеотидов, предполагая, что большая часть проблем с выпадением и однородностью связана с плохой однородностью в синтезе массива.Следовательно, использование более точного и однородного массива также должно уменьшить эти ограничения.
Наш протокол по своей природе склонен к созданию химер. Хотя они могут быть отфильтрованы в большинстве последующих приложений, они могут вызвать проблемы в более сложных реакциях из-за разбавления разработанной библиотеки. Мы смогли минимизировать количество химер до 21,5%, используя специальный сценарий, который исследует все возможные перекрестные гибридизации. В отдельном эксперименте без сценария мы определили, что количество химер достигает 42% (дополнительный рисунок S3).Однако, поскольку конструкции были разными, мы не можем провести прямое сравнение показателей химер.
Посредством Dial-Out PCR мы смогли получить безошибочные сборки для 25/25 целей. Однако мы заметили некоторую фоновую амплификацию, составляющую до 22% от секвенированного пула. Чтобы уменьшить этот шум в будущих экспериментах, мы предлагаем либо увеличить глубину секвенирования помеченного пула, либо применить более строгий фильтр для количества раз, когда конструкция наблюдалась в помеченном пуле.
Мы были ограничены синтезом 252-меров максимальной длиной олигонуклеотидов, которые мы смогли синтезировать в нашем входном пуле олигонуклеотидов (CustomArray, 160-mers). Однако, поскольку мы не наблюдали снижения выхода при увеличении размера мишени с 191–252 п.н. (дополнительный рисунок S4), мы полагаем, что размер цели можно увеличить, просто используя более длинные пулы олигонуклеотидов. Например, 230-меры Agilent позволят собрать 392-меры, используя нашу нынешнюю технику. По мере развития технологий массивов и появления более длинных олигонуклеотидов наш протокол будет пропорционально масштабироваться.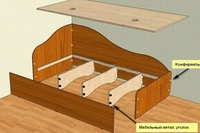 Более того, возможно, что наши попарные пулы можно будет использовать для иерархической сборки. Это могло произойти непосредственно после сборки или после цикла многократного извлечения исходящей PCR для уменьшения сложности и повышения единообразия. Наконец, возможно, что протокол может быть изменен для сборки наборов из трех или более олигонуклеотидов вместо пар в усовершенствованной версии метода синтеза дробовика, описанного Kim et al .
Более того, возможно, что наши попарные пулы можно будет использовать для иерархической сборки. Это могло произойти непосредственно после сборки или после цикла многократного извлечения исходящей PCR для уменьшения сложности и повышения единообразия. Наконец, возможно, что протокол может быть изменен для сборки наборов из трех или более олигонуклеотидов вместо пар в усовершенствованной версии метода синтеза дробовика, описанного Kim et al .
Наш протокол мультиплексной попарной сборки олигонуклеотидов ДНК, полученных из массива, обеспечивает метод недорогой сборки олигонуклеотидов с подтвержденной последовательностью из синтеза массива.Насколько нам известно, это первое исследование, в котором тысячи олигонуклеотидов, полученных из массива, были объединены в мультиплекс и использовался статический набор тегов ПЦР для извлечения молекул с подтвержденной последовательностью. Мы предлагаем применимость этого протокола как для создания сложных библиотек, так и для синтеза генов. Создание библиотеки из 3118 таких 200-меров будет в ~ 38 раз дешевле, чем методы синтеза на основе колонок (~ 0,84 доллара США за цель). Получение отдельных узлов с подтвержденной последовательностью для каждого из 3118 будет по-прежнему в 17 раз дешевле с собственными тегами Dial-Out и праймерами для извлечения и в 4 раза дешевле, включая единовременные затраты на тег Dial-Out и библиотеки поисковых праймеров (дополнительная таблица S3).В то время как синтез на основе колонки ограничен 200 основаниями, наш протокол синтезировал 252-меров по 0,84 долл. / Цель (0,0042 долл. / Основание) с такой же эффективностью, как и 200-меры (дополнительный рисунок S4). С появлением секвенирования следующего поколения высокопроизводительный функциональный скрининг ДНК пролил свет на механизмы регуляции генов (20–24) и классификацию вариантов с неопределенной значимостью (25). Возможность синтезировать определенные библиотеки по беспрецедентной цене позволит исследователям решать эти вопросы, используя точно разработанные последовательности, а не полагаться на предвзятые методы мутагенеза.
Создание библиотеки из 3118 таких 200-меров будет в ~ 38 раз дешевле, чем методы синтеза на основе колонок (~ 0,84 доллара США за цель). Получение отдельных узлов с подтвержденной последовательностью для каждого из 3118 будет по-прежнему в 17 раз дешевле с собственными тегами Dial-Out и праймерами для извлечения и в 4 раза дешевле, включая единовременные затраты на тег Dial-Out и библиотеки поисковых праймеров (дополнительная таблица S3).В то время как синтез на основе колонки ограничен 200 основаниями, наш протокол синтезировал 252-меров по 0,84 долл. / Цель (0,0042 долл. / Основание) с такой же эффективностью, как и 200-меры (дополнительный рисунок S4). С появлением секвенирования следующего поколения высокопроизводительный функциональный скрининг ДНК пролил свет на механизмы регуляции генов (20–24) и классификацию вариантов с неопределенной значимостью (25). Возможность синтезировать определенные библиотеки по беспрецедентной цене позволит исследователям решать эти вопросы, используя точно разработанные последовательности, а не полагаться на предвзятые методы мутагенеза. Более того, синтез генов способствовал созданию новых фармацевтических препаратов и лучшему пониманию организации генома, и мы ожидаем, что увеличение длины сборок ДНК, которые могут быть получены с помощью недорогого и сложного синтеза ДНК, откроет новые возможности для дизайна белков и синтетической биологии. .
Более того, синтез генов способствовал созданию новых фармацевтических препаратов и лучшему пониманию организации генома, и мы ожидаем, что увеличение длины сборок ДНК, которые могут быть получены с помощью недорогого и сложного синтеза ДНК, откроет новые возможности для дизайна белков и синтетической биологии. .
Мы благодарим сотрудников лабораторий Шендуре и Бейкера (в частности, Э. Бойля, М. Снайдера, М. Кирчер, М. Гасперини и К. Ли), а также S. Brothers за полезные обсуждения.Д. и Дж. являются исследователями Медицинского института Говарда Хьюза.
Вклад авторов: Проект был задуман и разработан J.C.K., M.J.L., J.J.S., J.N., D.B. и Дж. J.C.K. и J.J.S. разработаны теги in silico Dial-Out. E.M.S. разработан сценарий для фрагментации целей. J.C.K. проводил эксперименты и анализ данных. J.C.K. и Дж. написал рукопись. Все авторы прочитали и одобрили окончательную версию рукописи.
ФИНАНСИРОВАНИЕ
Министерство энергетики — Национальная лаборатория Лоуренса Беркли — Объединенный институт генома [DE-AC02–05Ch21231, J. С.]; Национальные институты здравоохранения (NIH) [1R21CA160080 — J.S.]; Фонд Билла и Мелинды Гейтс [OPP1120319 — Д. Б.]; Вашингтонский исследовательский фонд [Стипендия Вашингтонского исследовательского фонда для получения докторской степени по инновациям в M.J.L.]. Финансирование платы за открытый доступ: фонды HHMI доктора Шендуре.
С.]; Национальные институты здравоохранения (NIH) [1R21CA160080 — J.S.]; Фонд Билла и Мелинды Гейтс [OPP1120319 — Д. Б.]; Вашингтонский исследовательский фонд [Стипендия Вашингтонского исследовательского фонда для получения докторской степени по инновациям в M.J.L.]. Финансирование платы за открытый доступ: фонды HHMI доктора Шендуре.
Заявление о конфликте интересов . Ничего не объявлено.
ССЫЛКИ
1.Дезоксинуклеозид фосфорамидиты — новый класс ключевых промежуточных продуктов для синтеза дезоксинуклеотидов
Tetrahedron Lett.
1981
22
1859
1862
2.Крупномасштабный de novo Синтез ДНК: технологии и приложения
Nat. Методы
2014
11
499
507
3.Масштабируемый синтез генов путем селективной амплификации пулов ДНК с высокоточных микрочипов
Nat. Biotechnol.
Biotechnol.
2010
28
1295
1299
4.Параллельный синтез генов в микрофлюидном устройстве
Nucleic Acids Res.
2007
25
e61
5.Матрицы олигонуклеотидов высокой плотности
Биосенс. Биоэлектрон.
1996
11
687
690
6.и другие.
Профилирование экспрессии с использованием микроматриц, изготовленных струйным синтезатором олигонуклеотидов
Nat. Biotechnol.
2001
19
342
347
7.In situ Синтез ДНК-микрочипа на функционализированном субстрате сополимера циклического олефина
ACS Appl. Матер. Интерфейсы
Матер. Интерфейсы
2010
2
491
497
8.и другие.
Матрицы олигонуклеотидов Combimatrix: генотипирование и анализы экспрессии генов с использованием электрохимического обнаружения
Биосенс. Биоэлектрон.
2007
22
1853
1860
9.Белковая коррекция ошибок для de novo Синтез ДНК
Nucleic Acids Res.
2004
32
e162
10.Устранение ошибок в ДНК, синтезированной микрочипом, с использованием иммобилизованной MutS
Nucleic Acids Res.
2014
42
e102
11.
Исправление ошибок в синтетической ДНК путем консенсусной перетасовки
Nucleic Acids Res.
2005
33
e55
12.Синтез гена путем амплификации кольцевой сборки
Nat.Методы
2008
5
37
39
13.Удаление мутантных последовательностей, продуцируемых полимеразой, из продуктов ПЦР
Proc. Natl. Акад. Sci. США
1997
94
6847
6850
14.Двухэтапный метод тотального синтеза гена
Nucleic Acids Res.
2004
32
e59
15.Удаление несовпадающих оснований из синтетических генов путем ферментативного расщепления несовпадающих оснований
Nucleic Acids Res.
2005
33
e58
16.
и другие.
Синтетическое поколение вирусов для вакцины против гриппа для быстрого реагирования на пандемии
Sci.Пер. Med.
2013
5
185ra68
17.Точный синтез генов с помощью метки-ориентированного извлечения молекул ДНК с подтвержденной последовательностью
Nat. Методы
2012
9
913
915
18.и другие.
Синтез генов высокой точности путем извлечения ДНК с подтвержденной последовательностью, идентифицированной с помощью высокопроизводительного пиросеквенирования
Nat. Biotechnol.
Biotechnol.
2010
28
1291
1294
19.«Синтез ДНК из дробовика» для высокопроизводительного конструирования больших молекул ДНК
Nucleic Acids Res.
2012
40
e140
20.Анализ регуляторных элементов ДНК с высоким разрешением методом синтетического мутагенеза насыщения
Nat. Biotechnol.
2009
27
1173
1175
21.Вывод регуляторной логики гена на основе высокопроизводительных измерений тысяч систематически разработанных промоторов
Nat. Biotechnol.
2012
30
521
530
22.Синтетическая конструкция сильных промоторов
Proc. Natl. Акад. Sci. США
2010
107
2538
2543
23.
и другие.
Систематическое вскрытие и оптимизация индуцибельных энхансеров в клетках человека с использованием массового параллельного анализа репортеров
Nat.Biotechnol.
2012
30
271
277
24.Массовое параллельное декодирование регуляторных последовательностей млекопитающих поддерживает гибкую организационную модель
Nat. Genet.
2013
45
1021
1028
25.Редактирование насыщения участков генома с помощью множественной гомологически направленной репарации
Природа
2014
513
120
123
26.
Параллельный синтез генов на кристалле и применение для оптимизации экспрессии белков
Nat. Biotechnol.
2011
29
449
452
27.Точный мультиплексный синтез генов из программируемых микрочипов ДНК
Природа
2004
432
1050
1054
28.и другие.
Микрожидкостный синтез олигодезоксинуклеотидов и одновременная сборка множественных последовательностей ДНК
Nucleic Acids Res.
2004
32
5409
5417
29.Сборка высококачественных генов непосредственно из неочищенных смесей олигонуклеотидов, синтезированных с помощью микрочипов
Nucleic Acids Res.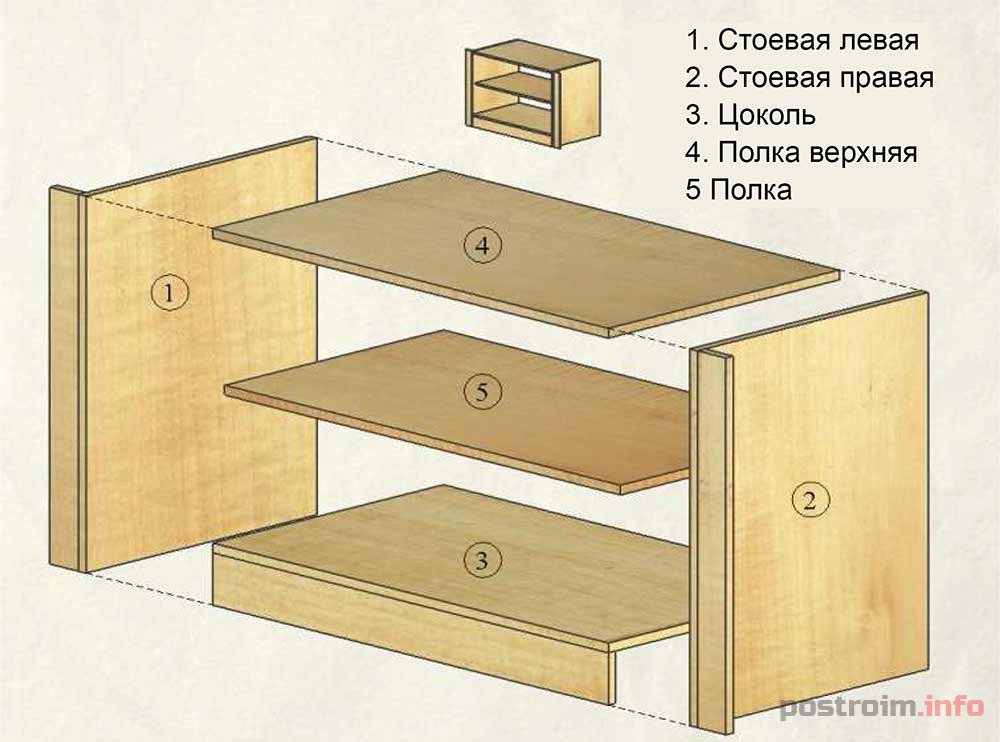
2010
38
e180
30.Рекурсивное конструирование совершенных молекул ДНК из несовершенных олигонуклеотидов
Мол. Syst. Биол.
2008
4
31.Эволюционные силы действуют на длину промотора: идентификация обогащенных цис-регуляторных элементов
Мол.Биол. Evol.
2009
26
1299
1307
32.Регуляция транскрипции и разнообразие животных
Природа
2003
424
147
151
33.Благоприятный размер домена в белках
фолд. Des.
1998
3
11
17
34.Термодинамика и ЯМР внутренних несоответствий G.T в ДНК
Биохимия
1997
36
10581
10594
35.
Метод ПЦР с высоким плексом для массового параллельного секвенирования
Биотехника
2013
55
69
74
36.UNAFold: программное обеспечение для фолдинга и гибридизации нуклеиновых кислот
Methods Mol.Биол.
2008
453
3
31
37.Молекулярное клонирование: лабораторное руководство
1989
Колд-Спринг-Харбор, Нью-Йорк
Лабораторный пресс в Колд-Спринг-Харбор
38.PEAR: быстрое и точное слияние парного считывания Illumina
Биоинформатика
2014
30
614
620
© Автор (ы) 2015.Опубликовано Oxford University Press от имени Nucleic Acids Research.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Противоположное действие изоформ M1 и M23
иммунопреципитация, содержащая субъединицы M1 и M23.
Тем не менее стехиометрия в головном мозге и скелетных мышцах
показала, что полипептиды M23 превосходят полипептиды M1 по крайней мере на
3: 1 (4, 5). Полипептиды M23 и M1 идентичны, за исключением пептида из 22 остатков
на N-конце M1. Неизвестно, как
этот дополнительный сегмент мешает сборке квадратного массива,
, потому что атомные структуры гомологичных белков
не разрешают N- и C-концы (20, 32–34).
Актуальность сборки квадратного массива AQP4 для физиологии и патофизиологии мозга неизвестна. Наши исследования
показывают, что M1 и M23 могут ограничивать сборку квадратного массива AQP4
до предпочтительного размера, но не ясно, почему это важно. AQP4 имеет сильно поляризованное распределение в мозге. Он
значительно обогащен периваскулярной мембраной астроглиальных клеток
, а также глии на поверхностях мозга (7, 8) и сетчатке
(9).AQP4 может высвобождать воду из метаболизма мозга и может восстанавливать осмотическое равновесие во время сифонирования калия после высокой активности нейронов
(11, 12). Недавние исследования показывают, что
AQP4 прикрепляется к периваскулярным мембранам за счет ассоциации с
дистрофин-ассоциированными белками посредством взаимодействия с
␣
-синтрофином (5, 12, 13, 35). Один связывающий белок может связывать
квадратный массив, содержащий множество белков AQP4, с этоном цитоскеля
, тогда как для каждого из диспергированных тетрамеров AQP4 может потребоваться связка
.Диссоциация квадратных массивов может происходить во время ишемии головного мозга
или другого нервного стресса (14, 36). Если разделение массивов квадратных
должно происходить быстро, организация AQP4 в большие плоты
может помешать разборке. Уравновешивание противоположных действий
изоформ M1 и M23 AQP4 в концевых ногах астроцитов
может обеспечить оптимальный размер массивов для эффективного связывания на
периваскулярной мембраны без нарушения способности
быстро разбираться.
Мы благодарим Арвида Маунсбаха и Каору Мицуока за критические оценки
рукописи и Йорга Кистлера за проницательные комментарии. Эта работа
была поддержана грантами Национального института здравоохранения NS-38121,
NS-44010 и NS-44395 (для JER) и HL-33991, HL-48268 и
EY-11239 (для PA) и Программой Human Frontier Science Program (до
PA).
1. Агре, П., Кинг, Л. С., Ясуи, М., Гуггино, В. Б., Оттерсен, О. П., Фудзиёси, Ю.,
Engel, A. & Nielsen, S. (2002) J. Physiol. 542, 3–16.
2. Лу, М., Ли, М. Д., Смит, Б. Л., Юнг, Дж. С., Агре, П., Вердейк, М. А., Мерккс,
Г., Райсс, Дж. П. и Дин, П. М. (1996) Proc. Natl. Акад. Sci. USA 93,
10908–10912.
3. Юнг, Дж. С., Бхат, Р. В., Престон, Г. М., Гуджино, В. Б., Барабан, Дж. М. и Агре,
П. (1994) Proc. Natl. Акад. Sci. USA 91, 13052–13056.
4. Нили, Дж. Д., Кристенсен, Б. М., Нильсен, С.И Агре П. (1999) Biochemistry 38,
11156–11163.
5. Neely, J. D., Amiry-Moghaddam, M., Ottersen, O. P., Froehner, S. C., Agre,
P. & Adams, M. E. (2001) Proc. Natl. Акад. Sci. USA 98, 14108–14113.
6. Нильсен, С., Смит, Б. Л., Кристенсен, Э. И. и Агре, П. (1993) Proc. Natl. Акад.
Sci. USA 90, 7275–7279.
7. Nielsen, S., Nagelhus, E. A., Amiry-Moghaddam, M., Bourque, C., Agre, P. &
Ottersen, O.П. (1997) J. Neurosci. 17, 171–180.
8. Фригери А., Гроппер М. А., Умениши Ф., Кавашима М., Браун Д. и
Веркман А. С. (1995) J. Cell Sci. 108, 2993–3002.
9. Нагельхус, Э. А., Веруки, М. Л., Торп, Р., Хауг, Ф. М., Лааке, Дж. Х., Нильсен,
С., Агре, П. и Оттерсен, О. П. (1998) J. Neurosci. 18, 2506–2519.
10. Мэнли, Г. Т., Фуджимура, М., Ма, Т., Ношита, Н., Филиз, Ф., Боллен, А. В., Чан,
П., Веркман, А. С.(2000) Нат. Med. 6, 159–163.
11. Amiry-Moghaddam, M., Williamson, A., Palomba, M., Eid, T., de Lanerolle,
NC, Nagelhus, EA, Adams, ME, Froehner, SC, Agre, P. & Ottersen,
OP (2003) Proc. Natl. Акад. Sci. USA 100, 13615–13620.
12. Amiry-Moghaddam, M., Otsuka, T., Hurn, PD, Traystman, RJ, Haug,
F.-M., Froehner, SC, Adams, ME, Neely, JD, Agre, P. , Ottersen, OP
и Bhardwaj, A. (2003) Proc.Natl. Акад. Sci. USA 100, 2106–2111.
13. Vajda, Z., Pedersen, M., Fuchtbauer, EM, Wertz, K., Stodkilde-Jorgensen,
H., Sulyok, E., Doczi, T., Neely, JD, Agre, P. , Frokiaer, J. & Nielsen, S. (2002)
Proc. Natl. Акад. Sci. USA 99, 13131–13136.
14. Wolburg, H. (1995) J. Hirnforsch. 36, 239–258.
15. Ландис Д. М. и Риз Т. С. (1974) J. Cell Biol. 60, 316–320.
16. Ван Хук, А. Н., Янг, Б., Кирмиз, С., Браун, Д.(1998) J. Membr. Биол. 165,
243–254.
17. Ян Б., Браун Д. и Веркман А. С. (1996) J. Biol. Chem. 271, 4577–4580.
18. Verbavatz, J. M., Ma, T., Gobin, R. & Verkman, A. S. (1997) J. Cell Sci. 110,
2855–2860.
19. Rash, J. E., Yasumura, T., Hudson, C. S., Agre, P. & Nielsen, S. (1998) Proc.
Нац. Акад. Sci. USA 95, 11981–11986.
20. Суи, Х., Хан, Б. Г., Ли, Дж. К., Валиан, П. и Яп, Б. К. (2001) Nature 414,
872–878.
21. Террис, Дж., Эсельбаргер, К. А., Марплс, Д., Неппер, М. А. и Нильсен, С. (1995)
Am. J. Physiol. 269, F775 – F785.
22. Rash, J. E. & Yasumura, T. (1999) Cell Tissue Res. 296, 307–321.
23. Филлипс Т. Э. и Бойн А. Ф. (1984) J. Electron Microsc. Tech. 1, 9–29.
24. Раш, Дж. Э., Даффи, Х. С., Дудек, Ф. Э., Билхарц, Б. Л., Уэлен, Л. Р.,
Ясумура, Т. (1997) J. Comp Neurol. 388, 265–292.
25.Раш, Дж. Э. и Ясумура, Т. (1992) Microsc. Res. Tech. 20, 187–204.
26. Fujimoto, K. (1995) J. Cell Sci. 108, 3443–3449.
27. Fujimoto, K. (1997) Histochem. Cell Biol. 107, 87–96.
28. Рэш, Дж. Э. и Гиддингс, Ф. Д. (1989) J. Electron Microsc. Tech. 13, 204–215.
29. Ландис Д. М. и Риз Т. С. (1981) J. Cell Biol. 88, 660–663.
30. Neuhaus, J., Schmid, E. M., Wolburg, H. (1990) Neurosci. Lett. 109, 163–168.
31.Лэндис, Д. М. и Риз, Т. С. (1981) J. Exp. Биол. 95, 35–48.
32. de Groot, B. L., Engel, A. & Grubmuller, H. (2001) FEBS Lett. 504, 206–211.
33. Мурата, К., Мицуока, К., Хираи, Т., Вальц, Т., Агре, П., Хейманн, Дж. Б., Энгель,
А. и Фудзиёси, Ю. (2000) Nature 407, 599–605.
34. Фу Д., Либсон А., Мирке Л. Дж., Вайцман К., Ноллерт П., Кручински Дж. И
Страуд Р. М. (2000) Science 290, 481–486.
35. Нико Б., Frigeri, A., Nicchia, G. P., Corsi, P., Ribatti, D., Quondamatteo, F.,
Herken, R., Girolamo, F., Marzullo, A., Svelto, M., et al. (2003) Glia 42,
235–251.
36. Cuevas, P., Gutierrez Diaz, J. A., Dujovny, M., Diaz, F. G. & Ausman, J. I.
(1985) Anat. Эмбриол. (Берлин) 172, 171–175.
13614
兩
www.pnas.org 兾 cgi 兾 doi 兾 10.1073 兾 pnas.2235843100 Furman et al.
Детерминанты сборки аквапорина-4 в ортогональных массивах, выявленные с помощью флуоресцентной визуализации одиночных молекул живых клеток
Резюме
Мы исследовали молекулярные детерминанты сборки аквапорина-4 (AQP4) в ортогональных массивах частиц (OAP) путем визуализации флуоресцентно меченных мутантов AQP4 в клеточных мембранах с использованием трекинга одиночных частиц с помощью квантовых точек и флуоресцентной микроскопии полного внутреннего отражения.Полноразмерная «длинная» (M1) форма AQP4 свободно диффундирует в мембраны и не образует OAP, тогда как «короткая» (M23) форма AQP4 образует OAP и практически неподвижна. Анализ мутантов с делецией AQP4 выявил прогрессирующее разрушение OAP путем добавления трех-семи остатков на N-конце AQP4-M23, причем полиаланины были столь же эффективны, как и нативные фрагменты AQP4. OAP исчезают после делеций AQP4-M23 ниже по течению, что, как показывает анализ точечных мутантов, включает N-концевые взаимодействия остатков Val24, Ala25 и Phe26.Образование OAP также предотвращалось введением остатков пролина в сайты сразу после гидрофобного N-конца AQP4-M23. AQP1, гомолог AQP4, который не образует OAP, был индуцирован к образованию OAP при замене его N-концевого домена доменом AQP4-M23. Наши результаты показывают, что образование OAP с помощью AQP4-M23 стабилизируется гидрофобными межмолекулярными взаимодействиями с участием N-концевых остатков, и что отсутствие OAP в AQP4-M1 является результатом неселективного блокирования этого взаимодействия семью остатками непосредственно перед Met23.
Введение
Ортогональные массивы частиц (OAP) представляют собой регулярные квадратные массивы внутримембранных частиц, которые были визуализированы с помощью электронной микроскопии замораживания-разрушения (FFEM) в клеточных мембранах в головном мозге (Landis and Reese, 1974; Rash et al., 1974), почках (Orci et al., 1981; Verbavatz et al., 1994), скелетные мышцы (Ellisman et al., 1976; Hatton et al., 1987) и другие ткани (обзор Wolburg, 1995). Биологическое значение этих уникальных структур долгое время было предметом предположений, поскольку их появление коррелировало с различными нервно-мышечными заболеваниями (Hatton and Ellisman, 1982; Schotland et al., 1981). Сначала мы предположили, что водный канал аквапорин-4 (AQP4) является основным компонентом OAP, основываясь на его экспрессии в нескольких типах клеток, которые, как известно, демонстрируют матричные структуры (Frigeri et al., 1995), что было подтверждено демонстрацией образования OAP в AQP4. -трансфицированные клетки (Yang et al., 1996) и отсутствие OAP в тканях мышей с нокаутом, лишенных AQP4 (Verbavatz et al., 1997). Электронная микроскопия разрушения метки подтвердила, что OAPs содержат AQP4 (Rash et al., 1998). Поскольку AQP4 функционирует как белок, переносящий воду в отростках стопы глиальных клеток, было высказано предположение, что OAP могут усиливать движение воды через поры AQP4 (Silberstein et al., 2004; Ван Хук и др., 2000; Yang et al., 1997) и поддерживают поляризацию AQP4 в отростках стопы (Amiry-Moghaddam et al., 2004).
Транскрипт AQP4 содержит альтернативные сайты инициации трансляции (Hasegawa et al., 1994), давая полноразмерную «длинную» (M1) изоформу (AQP4-M1) ~ 34 кДа и «короткую» (M23) изоформу ( AQP4-M23) ~ 31 кДа (Jung et al., 1994; Lu et al., 1996). Обе изоформы AQP4 функционируют как водные каналы, хотя их относительное количество зависит от ткани, при этом мозг экспрессирует обе изоформы, а почки, скелетные мышцы, желудок и легкие экспрессируют преимущественно AQP4-M23 (Frigeri et al., 1995; Hatton et al., 1987; Neely et al., 1999). Недавнее исследование генома мозга крысы предложило четыре дополнительных изоформы AQP4, одна из которых представляет собой функциональный водный канал массой 39 кДа, содержащий дополнительный 41 остаток на N-конце AQP4-M1, который был обнаружен на очень низких уровнях с помощью вестерн-блоттинга у крыс. мозг (Moe et al., 2008).
FFEM в трансфицированных клетках показал, что AQP4-M23 собирается в большие OAP из> 100 частиц, тогда как AQP4-M1 преимущественно диспергирован, образуя небольшое количество небольших массивов, если таковые имеются.В первичных астроцитах и в клетках, котрансфицированных AQP1-M1 и AQP4-M23, OAP в среднем значительно меньше, чем в клетках, трансфицированных только AQP4-M23 (Furman et al., 2003; Silberstein et al., 2004), что указывает на взаимодействие между этими преобладающими изоформами AQP4, которое, вероятно, ограничивает размер, до которого собираются массивы in vivo. Специфическая природа и места межмолекулярных взаимодействий, ответственных за образование и разрушение OAP, в настоящее время являются предметом интенсивных спекуляций и исследований.
Недавно мы разработали флуоресцентные методы для визуализации OAP в живых клетках (Crane et al., 2008). Диффузию отдельных молекул AQP4, меченных квантовыми точками на сконструированном внешнем эпитопе, измеряли с помощью трекинга одной частицы. AQP4-M1 свободно и быстро диффундировал на плазматические мембраны клеток, тогда как диффузия AQP4-M23 была сильно ограничена из-за образования OAP. Количественный анализ траекторий одиночных молекул позволил определить долю молекул AQP4 в ОАП и их диффузионные характеристики.Прямая визуализация OAP в клеточных мембранах была выполнена с использованием флуоресцентной микроскопии полного внутреннего отражения, в которой AQP4 был сильно помечен небольшим флуорофором, а интенсивность кластера была принята в качестве меры размера OAP.
Целью этого исследования было установить, используя визуализацию живых клеток, молекулярные детерминанты сборки OAP в клеточных мембранах. Чтобы определить роль конкретных доменов в изоформах AQP4, мы изучили диффузионное поведение большого числа мутантов AQP4, индивидуально трансфицированных в клетки COS-7.Мы обнаружили, что образование OAP в AQP4-M23 требует гидрофобного взаимодействия с участием специфических остатков сразу после Met23, тогда как остатки в AQP4-M1 перед Met23 предотвращают образование OAP посредством неспецифического блокирующего взаимодействия.
Результаты
Визуализация AQP4 OAP в клеточных мембранах
Мы использовали одночастичное отслеживание (SPT) AQP4, меченного квантовыми точками (Qdot), чтобы различать молекулы AQP4 в быстро диффундирующих индивидуальных тетрамерах и молекулы, иммобилизованные путем накопления в OAP (рис.1А). Qdots были прикреплены посредством связывания антитела с сконструированным эпитопом Myc во второй внеклеточной петле AQP4 (рис. 1B). Эта вставка не ингибирует трафик AQP4 или функцию водных каналов, а также не предотвращает образование AQP4 OAP (Crane et al., 2008). Траектории от AQP4-M1 и AQP4-M23, полученные с частотой 91 Гц в течение 6 секунд, показывают очень разное поведение (рис. 1A, справа). Диффузия AQP4-M1 в основном броуновская, со средним коэффициентом диффузии D 1-3 ∼5 × 10 –10 см 2 / сек, тогда как диффузия AQP4-M23 сильно ограничена.График зависимости MSD от времени, рассчитанный на основе множества траекторий Qdot для AQP4-M23, показывает характерную отрицательную кривизну, ожидаемую для ограниченной или аномальной диффузии (рис. 1C), при этом средний коэффициент диффузии и диапазон в 1 секунду на порядок ниже, чем у AQP4-M1 (рис. 1C, D). Мы также использовали TIRFM для прямой визуализации распределения меченного эпитопом AQP4 в клеточных мембранах (рис. 1E). Для визуализации TIRFM для сильного окрашивания AQP4 с помощью Alexa Fluor 555 были использованы концентрации первичных антител в 20 раз и вторичных антител в 100 раз по сравнению с теми, которые использовались для SPT.Клетки фиксировали до мечения, чтобы предотвратить кластеризацию AQP4 из-за перекрестного связывания, которое происходит с высокими концентрациями антител. Трансфицированные AQP4-M1 и AQP4-M23 наблюдались во всех областях плазматической мембраны клетки, при этом AQP4-M23 сгруппированы в отдельные точки дифракционно ограниченного размера, а AQP4-M1 относительно равномерно распределены по поверхности клетки (рис. 1E).
Рис. 1.Сборка мембраны и диффузионная подвижность изоформ M1 и M23 AQP4.(A) Схема, показывающая организацию тетрамеров AQP4 (слева) и репрезентативные траектории одиночных частиц (справа) меченных Qdot молекул AQP4 в плазматических мембранах клеток COS-7, экспрессирующих AQP4-M1 (вверху) или AQP4-M23 (внизу) . Каждый серый цилиндр представляет собой один тетрамер AQP4. Подмножество молекул AQP4 помечено квантовыми точками (красными) для отслеживания отдельных частиц. (B) Последовательность и топология AQP4. Черным обозначены сайты инициации трансляции Met1 и Met23; оранжевый, спроектированный сайт Myc; синий — остатки, в которых единичные мутации не влияли на образование или разрушение OAP; красный — остатки, в которых одиночные мутации значительно нарушили OAP; розовый — остатки, в которых единичные мутации слегка нарушают OAP; желтый — остатки, в которых мутация вызвала потерю экспрессии плазматической мембраны; и зеленый, С-концевые PDZ-связывающие домены.Горизонтальные линии указывают места усечений С-конца. (C) Комбинированные графики зависимости MSD от времени и усредненные коэффициенты диффузии для AQP4-M1 (серый) и AQP4-M23 (черный) в ячейках COS-7. (D) Кумулятивное распределение вероятностей диапазонов за 1 секунду [ P (диапазон)] для AQP4-M1 (серый) и AQP4-M23 (черный), пунктирные линии указывают средний диапазон. (E) Микрофотографии TIRF меченных Alexa Flour 555 AQP4-M1 и AQP4-M23 в клетках COS-7. На вставке показана увеличенная площадь 4 × 4 мкм. Масштабная линейка: 10 мкм.
Мутанты с делецией AQP4 демонстрируют заметно измененную способность образовывать OAP
Мы создали серийные делеционные мутанты, чтобы исследовать, ответственны ли специфические остатки в AQP4-M1 между Met1 и Met23 за предотвращение образования OAP.Мутанты с делецией были названы по положению N-концевого метионина относительно Met1 в полноразмерном AQP4-M1. Удаление до 16 остатков с N-конца (M1-M16) мало влияет на диффузию AQP4 (фиг. 2A), указывая на присутствие небольшого количества OAP, если таковые имеются. Однако удаление Cys17 привело к образованию большой фракции AQP4 с ограниченной диффузией (например, дополнительный материал Movie 1). Расчетный процент мутантов AQP4 в OAP, основанный на 95-м процентиле диапазонов для AQP4-M23 за 1 секунду (пунктирные линии на рис.2A, B, C) (см. «Материалы и методы») обобщены на рис. 2D. По этому критерию 42-48% M17 присутствовали в OAP. Дальнейшие делеции увеличивали процентное содержание AQP4 в OAP с 84-90% для M20 и 92-96% для M21 (рис. 2A, D). Эти данные в целом согласуются с недавним исследованием подобных делеционных мутантов FFEM (Suzuki et al., 2008), за исключением того, что авторы обнаружили необъяснимое снижение образования OAP для мутантов M18 и M19, тогда как здесь мы обнаружили постоянно увеличивающуюся долю AQP4 в OAP между M17 и AQP4-M23 (рис.2D). Усечения ниже Met23 вызывают прогрессирующую потерю OAP от M25 к M27 (Fig. 2B, D), хотя дальнейшие усечения приводят к потере экспрессии мембран.
AQP4 также содержит цитоплазматический C-концевой домен из 73 остатков (рис. 1B). Удаление до 71 остатка с С-конца не влияло на диффузию AQP4-M1 или AQP4-M23 (фиг. 2C, D). Делеция или мутация остатка 72 на С-конце (Phe252) приводила к потере экспрессии плазматической мембраны. На основании кристаллических контактов в электронной кристаллографической структуре AQP4 Хироаки и его коллеги предположили, что солевой мостик между Arg108 и Tyr250 в первую очередь ответственен за образование OAP (Hiroaki et al., 2006). Чтобы проверить это, мы создали мутанты аланина по этим остаткам. Мы обнаружили, что диффузия M23-R108A идентична диффузии AQP4-M23 (рис. 2C, D), тогда как M23-Y250A не экспрессируется на плазматической мембране. Следовательно, контакты субъединица-субъединица, наблюдаемые в 2D кристаллах AQP4, не являются теми же взаимодействиями, которые ответственны за образование OAP в мембранах живых клеток.
Рис. 2.мутантов AQP4 с N-концевой делецией демонстрируют измененную способность образовывать OAP.(A) P (диапазон) для указанных мутантов усечения AQP4 перед Met23: M16 (красный), M17 (зеленый), M18 (темно-синий), M19 (голубой), M20 (оранжевый), M21 (фиолетовый). (B) P (диапазон) для усечений AQP4 после Met23: M24 (красный), M25 (зеленый), M26 (синий), M27 (оранжевый). (C) P (диапазон) для мутантного аланина M23-R108A (синий) и мутантов с C-концевой делецией: M23Δ6 (красный), M23Δ71 (зеленый), M1Δ6 (фиолетовый), M1Δ71 (оранжевый). P (диапазон) для AQP4-M23 (черный) и AQP4-M1 (серый) показаны на A-C для справки.Пунктирная линия указывает 95-й процентиль диапазона AQP4-M23. (D) Расчетный процент указанных мутантов AQP4 в OAP на основе 95-го процентиля диапазона для AQP4-M23. (E) Микрофотографии TIRF клеток COS-7, трансфицированных AQP4-M1, AQP4-M23 и мутантами с N-концевой делецией M16, M17 и M20. Каждое изображение представляет собой квадрат 5 × 5 мкм. Масштабная линейка: 2 мкм. (F) BN-PAGE (вверху) и SDS-PAGE (внизу) иммуноблоты клеточных лизатов из клеток COS-7, трансфицированных AQP4-M23, AQP4-M1 и мутантами с N-концевой делецией M16, M17 и M20.Справа указаны маркеры размера молекул.
В качестве независимого подтверждения того, что наблюдаемые изменения в диффузии делеционных мутантов между M16 и AQP4-M23 были вызваны образованием OAP, мы выполнили визуализацию TIRFM на сильно меченных фиксированных клетках COS-7 и электрофорез в полиакриламидном геле Blue-Native (BN-PAGE) на лизатах клеток COS-7. На рис. 2Е показаны микрофотографии TIRF размером 5 × 5 мкм. Практически вся флуоресценция AQP4-M23 исходила от отдельных, ограниченных дифракцией точек, соответствующих плотным OAP, тогда как флуоресценция AQP4-M1 была довольно однородной по поверхности клетки.Для BN-PAGE мы использовали неденатурирующие условия, как недавно сообщалось (Sorbo et al., 2008), для отделения тетрамеров AQP4 от комплексов AQP4 более высокого порядка. Иммуноблоттинг с первичным антителом против Myc на фиг. 2F показал диффузную полосу, мигрирующую при> 1200 кДа для AQP4-M23, что указывает на большие комплексы AQP4, а также меньшую полосу при ~ 300 кДа, соответствующую тетрамерам AQP4. AQP4-M1 показал плотную полосу тетрамера и слабую полосу при ~ 600 кДа, но не показал полосу с очень высокой молекулярной массой. Подобно AQP4-M1, TIRFM M16 в плазматической мембране не содержал четких дифракционно-ограниченных пятен, а BN-PAGE демонстрировал в основном плотную тетрамерную полосу.Для M17 и M20, где диффузия стала напоминать диффузию AQP4-M23, BN-PAGE дал несколько заметных полос выше, которые соответствуют тетрамерам AQP4, что указывает на структуры AQP4 более высокого порядка (рис. 2F). Аналогичным образом, с помощью TIRFM, дифракционно ограниченные точки становились видимыми в клетках, трансфицированных M17, и были более заметными с M20 (фиг. 2E). Никаких полос, мигрирующих быстрее, чем тетрамер AQP4, не было видно ни у одного вида после BN-PAGE. SDS-PAGE подтвердил молекулярную идентичность белков, визуализированных в нативном вестерн-блоте (рис.2F).
Рис. 3.Нарушение OAP остатками перед Met23 не является специфичным для последовательности. (A) P (диапазон) для мутаций аланина в AQP4-M1: M1-C13A / C17A (красный), M1-C17A (зеленый), M1-S18A (темно-синий), M1-R19A (голубой), M1 -E20A (оранжевый), AQP4-M23 (черный) и AQP4-M1 (серый). (B) Расчетный процент аланиновых мутантов AQP4-M1 в OAP. (C) N-концевые последовательности выбранных мутантов AQP4-M23, содержащие полипептиды, добавленные выше Met23.(D) P (диапазон) в результате добавления полипептида перед Met23: MA 2 M23 (красный), MA 4 M23 (зеленый), MA 6 M23 (темно-синий), MQ 6 M23 (фиолетовый), MVAFKGVM23 (оранжевый), M16 (голубой), AQP4-M23 (черный) и AQP4-M1 (серый). (E) Расчетный процент указанных мутантов с добавлением полипептида AQP4-M23 в OAP.
Молекулярные детерминанты предотвращения образования OAP в AQP4-M1
Чтобы изучить механизм, с помощью которого семь остатков выше Met23, по-видимому, нарушают образование OAP, мы измерили диффузию серии точечных мутантов AQP4-M1.Замены аланином в Cys17, Ser18, Arg19, Glu20, по отдельности или во всех четырех положениях вместе, не влияли на диффузию AQP4-M1 (фиг. 3A, B). Недавнее исследование Suzuki с соавторами (Suzuki et al., 2008), упомянутое выше, показало, что пальмитоилирование Cys13 или Cys17 необходимо для нарушения OAPs. Мы проверили этот вывод, измерив диффузию двойного мутанта, в котором оба цистеина были заменены на аланины (M1-C13A / C17A), которые не могут подвергаться пальмитоилированию. В отличие от заключения этих авторов, мы не обнаружили снижения диффузии, что указывает на то, что пальмитоилирование не требуется для разрушения OAP (рис.3А, Б). Чтобы далее очертить требования для разрушения OAP, мы сконструировали мутанты, у которых полиаланиновые или полиглутаминовые придатки различной длины были добавлены к N-концу AQP4-M23 (рис. 3C). Неожиданно, полиаланиновые придатки оказались эффективными при разрушении OAP, при этом MA 6 M23 имел идентичную диффузию с M16 и AQP4-M1 (рис. 3D, E). Однако отросток полиглутамина (MQ 6 M23) снижает содержание OAP только на ~ 10% по сравнению с AQP4-M23. Мы также сконструировали мутант (MVAFKGVM23), в котором первые семь остатков AQP4-M23 повторяются на N-конце (рис.3С). Этот «повторяющийся» мутант, который имел ту же длину, что и M16 и MA 6 M23, также показал полное нарушение образования OAP (рис. 3D, E). Таким образом, нарушение OAP происходит независимо от пальмитоилирования и не зависит от конкретных элементов последовательности AQP4 остатков перед Met23, причем неполярные остатки более эффективны при разрушении, чем полярные остатки.
Молекулярные детерминанты образования OAP в AQP4-M23
Из приведенных выше результатов мы предположили, что остатки AQP4 непосредственно перед Met23 нарушают OAPs в AQP4-M1, препятствуя взаимодействиям с участием остатков непосредственно после Met23.На фиг. 4A показаны первые 25 остатков AQP4-M23, нанесенные на шкалу гидропатии Кайта-Дулиттла (Kyte and Doolittle, 1982), которая является полезной оценкой склонности доменов к образованию гидрофобных пептид-пептидных взаимодействий или разделению на мембрана. Как это обычно делается для компенсации влияния близлежащих остатков на местную гидропатию, значение, нанесенное на график в каждой позиции на фиг. 4A, представляет собой текущую сумму пяти отдельных значений по шкале Кайта-Дулиттла с центром в названном остатке. График показывает, что N-конец AQP4-M23 является высокогидрофобным, с постепенно уменьшающейся гидропатией, перемещающейся внутрь к началу первой трансмембранной спирали в Gln32 (Hiroaki et al., 2006).
Сначала мы сконструировали серию одиночных мутаций аланина между Val24 и Phe34 (рис. 4B, D). Из этих одиночных мутаций замена аланина в Phe26 оказывала наибольшее влияние на диффузию, при этом только 66–73% M23-F26A включались в OAP. Хотя одиночная мутация аланина в Val24 (M23-V24A) не имела эффекта, двойной мутант (M23-V24A / F26A) был менее эффективен в образовании OAP (47-57% в OAP), чем M23-F26A. Замена заряженного полярного остатка Lys27 аланином не оказывает разрушающего действия.Образование OAP было лишь незначительно снижено в M23-V29A и M23-W30A (76–90% в OAP). M23-G28A, M23-T31A и M23-Q32A вели себя аналогично AQP4-M23, тогда как M23-F34A не экспрессировался на плазматической мембране. Результаты этого начального набора мутаций подтвердили, что гидрофобные и ароматические остатки ниже Met23 участвуют в образовании OAP.
Затем мы создали серию более серьезных мутаций глутамина на всех гидрофобных и ароматических остатках в этой области (рис. 4C, D).Замены глутамина в Ala25 или Phe26 приводили к очень низкому содержанию OAP (14-25% в OAP), тогда как замещение глутамина в Val24 было менее разрушительным (39-45% в OAP). Тройной мутант M23-V24Q / A25Q / F26Q вел себя аналогично одиночным мутантам M23-A25Q или M23-F26Q. Эти данные предполагают, что гидрофобное взаимодействие с участием N-концевых остатков важно для образования OAP, и что это взаимодействие может происходить очень близко к цитоплазматической поверхности плазматической мембраны. Поскольку мутации в Ala25 и Phe26 оказали наибольшее влияние на образование OAP тестируемых остатков, мы изучили дополнительные мутанты этих остатков (рис.4E, F). Удивительно, но мутация Ala25 в гидрофобный лейцин (M23-A25L) или консервативное снижение гидрофобности путем добавления гидроксильной группы (M23-A25S) оба привели к снижению содержания OAP (64-77% в OAP). Замена лейцином Phe26 (M23-F26L) не оказала никакого эффекта, тогда как добавление гидроксильной группы в этом положении (M23-F26Y) привело к даже более ограниченной диффузии, чем AQP4-M23, что свидетельствует о более жесткой структуре OAP (дополнительный материал, фильм 2) . Заряженные остатки глутамата (M23-F26E) и лизина (M23-F26K) были эффективны для снижения содержания OAP, но ни один из них не был более разрушительным, чем нейтральный полярный остаток глутамина в том же положении (рис.4F).
Рис. 4.N-концевых остатка сразу после Met23 ответственны за образование AQP4-M23 OAP. (A) График гидропатии Кайта-Дулиттла первых 25 остатков AQP4-M23 с использованием текущей суммы с 5 остатками. Пунктирная линия указывает начало первой трансмембранной спирали в соответствии с опубликованной кристаллической структурой (Hiroaki et al., 2006). * обозначает ароматические остатки. (B) P (диапазон) для мутаций аланина в AQP4-M23: M23-V24A (красный), M23-F26A (зеленый), M23-V24A / F26A (оранжевый), M23-K27A (темно-синий), M23- G28A (розовый), M23-V29A (голубой), M23-W30A (фиолетовый), M23-T31A (желтый), M23-Q32A (темно-зеленый).(C) P (диапазон) для точечных мутаций глутамина гидрофобных и ароматических остатков: M23-V24Q (красный), M23-A25Q (зеленый), M23-F26Q (темно-синий), M23-V24Q / A25Q / F26Q (оранжевый ), M23-W30Q (фиолетовый) и M23-A33Q (голубой). (D) Расчетный процент указанных точечных мутантов AQP4-M23 в OAP. (E) P (диапазон) следующие мутации AQP4-M23 на Ala25: M23-A25L (красный), M23-A25S (синий), M23-A25Q (зеленый). (F) P (диапазон) следующие мутации AQP4-M23 в Phe26: M23-F26L (красный), M23-F26A (зеленый), M23-F26Y (фиолетовый), M23-F26Q (темно-синий), M23-F26E (голубой), M23-F26K (оранжевый).(G) P (диапазон) после мутаций пролина в AQP4-M23: M23-K27P (зеленый), M23-K27A (синий), M23-G28P (красный), M23-G28A (розовый), с расчетным процентом пролина мутанты в OAPs приведены ниже. P (диапазон) для AQP4-M23 (черный) и AQP4-M1 (серый) показаны на B, C и E-G для справки.
Мы предположили, что эффективные межмолекулярные взаимодействия, продуцирующие OAPs, могут потребовать правильного позиционирования гидрофобного N-конца AQP4-M23 относительно гидрофобного связывающего кармана в соседних тетрамерах AQP4.Замена пролина сразу после N-конца AQP4-M23 может, таким образом, предотвращать взаимодействия, образующие OAP, путем нарушения вторичной структуры этого домена или введения жесткого излома, который предотвращает необходимые гидрофобные взаимодействия. Мы нацелены на остатки Lys27 и Gly28 для замены пролина, потому что эти остатки удалены из прямых гидрофобных взаимодействий, ответственных за образование OAP, из-за их низкой гидропатии, и поскольку замена аланина в этих положениях не предотвращает образование OAP (рис.4Б). На фиг. 4G показано, что замена пролина в Lys27 или Gly28 вызывает полное нарушение образования OAP с диффузией, идентичной диффузии AQP4-M1. Следовательно, мутации, изменяющие структуру N-конца, даже более эффективны для предотвращения OAP, чем мутации, которые значительно уменьшают гидропатию.
Чтобы проверить предсказание, что взаимодействия в N-концевом домене AQP4-M23 полностью ответственны за образование OAP, мы модифицировали AQP1, гомолог, который не формирует OAP, чтобы он содержал предполагаемые OAP-образующие элементы с N-конца AQP4.Выравнивание последовательностей AQP4 и AQP1 не показало сходства в коротких N-концевых цитоплазматических доменах белков, тогда как трансмембранные области имеют высокую идентичность последовательностей (de Groot et al., 2001; Hiroaki et al., 2006) (рис. 5A) . Следовательно, в первой химере AQP4-AQP1 (AQP1ch2) мы заменили Met1-Lys8 в AQP1 на Met23-Thr31 из AQP4-M23, полностью заменив цитоплазматический домен, но оставив первую трансмембранную спираль AQP1 нетронутой (рис. 5B). В качестве шаблона мы использовали конструкцию AQP1, которая была описана ранее (Crane, Verkman, 2008; Lu et al., 2000), который содержит эпитоп Myc в том же внеклеточном месте, что и все конструкции AQP4. Диффузия AQP1 в клетках COS-7 в основном броуновская и даже быстрее, чем AQP4-M1, с D 1-3 ∼8 × 10 –10 см 2 / сек (Crane and Verkman, 2008). Замена N-концевого домена AQP1 на домен AQP4-M23 приводит к резкому снижению диффузии (рис. 5C; дополнительный материал Movie 3), при этом 76-89% AQP1ch2 демонстрируют поведение, подобное OAP (рис.5D). Экспрессия AQP1ch2 на плазматической мембране была ниже, чем у большинства конструкций AQP4, что исключает визуализацию OAP с помощью TIRFM или FFEM. Чтобы узнать больше о минимальных требованиях для образования OAP, были сконструированы три дополнительные химеры AQP4-AQP1. AQP1ch3 имеет ту же общую длину, что и AQP1ch2, но вместо замены всего N-концевого домена AQP1 только первые три остатка (Met-Ala-Ser) были заменены первыми четырьмя остатками (Met-Val-Ala-Phe) из AQP4-M23. Эти четыре остатка составляют гидрофобный домен, в котором мутации или делеции в AQP4-M23 привели к значительному увеличению диффузии (рис.4) ( P <0,01). Диффузия AQP1ch3 была сравнима с диффузией немодифицированного AQP1 (рис. 5C, D) с D 1-3 ∼6 × 10 –10 см 2 / сек, что указывает на то, что четыре N-концевых остатка AQP4-M23 недостаточно для образования OAP. В AQP1ch4 снова был добавлен весь N-концевой домен из девяти остатков AQP4-M23, но смещенный дальше к N-концу AQP1, заменяя только Met1-Glu4 вместо всех восьми N-концевых остатков AQP1.В AQP1ch5 те же девять остатков AQP4 снова были полностью сдвинуты к N-концевому концу AQP1 (фиг. 5B). И AQP1ch4, и AQP1ch5 показали более медленную диффузию, чем нативный AQP1 и AQP1ch3, но не показали ограниченной диффузии, наблюдаемой в AQP1ch2 (рис. 5C). Следовательно, положение девяти N-концевых остатков AQP4-M23 относительно трансмембранной спирали 1 является критическим для образования OAP. Наконец, мы сконструировали ревертантный мутант AQP1ch2 (ch2-F26Q), аналогичный OAP-разрушающему мутанту M23-F26Q (рис.5Б). Как и в случае AQP4-M23, мутация Phe26 в глутамин в AQP1ch2 привела к значительному увеличению диффузии ( P <0,001), что соответствует расчетной фракции OAP 26-35% (рис. 5C, D).
Обсуждение
Идентичность и детерминанты OAP вызывают постоянный интерес с момента их открытия на электронных микрофотографиях замороженных переломов ткани мозга в 1970-х годах. Многочисленные исследования выявили корреляцию между OAP и различными заболеваниями головного мозга и скелетных мышц, при этом биологическая роль (и) OAP остается предметом интенсивных спекуляций.Здесь мы использовали изменения в диффузии через плазматическую мембрану мутантов AQP4, чтобы установить молекулярные детерминанты образования OAP. Мы использовали комбинацию N-концевых делеций и добавлений, сайт-направленный мутагенез и конструирование химер AQP4-AQP1 для определения ключевого домена, необходимого для стабильности OAP. Наши данные показывают, что один остаток не отвечает за взаимодействия тетрамер-тетрамер, ведущие к образованию OAP, но указывают на участие нескольких гидрофобных остатков на N-конце AQP4-M23.Неспособность AQP4-M1 образовывать OAPs возникает в результате неселективного блокирования N-концевых взаимодействий остатками непосредственно перед Met23.
Диффузионное поведение различных мутантов и химер AQP4 было количественно определено в живых клетках путем одночастичного отслеживания Qdots, связанных с обращенным к внеклеточному эпитопу Myc. Этот метод был недавно установлен в качестве надежного считывания образования, ассоциации и динамики OAP (Crane et al., 2008). Сравнение кумулятивных распределений вероятности распространения варианта AQP4 с известными распределениями природных изоформ AQP4 обеспечило оценку накопления AQP4 в OAP.До недавнего времени единственным доступным методом идентификации OAP в клеточных мембранах был FFEM. В сочетании с мечением иммунным золотом, FFEM использовался для оценки доли природных изоформ AQP4 (Furman et al., 2003) и мутантов AQP4 (Suzuki et al., 2008), которые ассоциируются в OAPs. Однако, помимо технических проблем, ограничения FFEM включают артефакты фиксации, сложность получения статистически точной информации о количестве тетрамеров AQP4 в OAP и сложность идентификации OAP в клетках, экспрессирующих низкие уровни AQP.FFEM часто требует значительного обогащения клеточных популяций или создания стабильных линий клеток с избыточной экспрессией AQP. Мечение Qdot меченных эпитопом AQP и измерение SPT снимают эти ограничения. Недавно BN-PAGE был продемонстрирован как альтернатива FFEM для идентификации OAP (Sorbo et al., 2008), что было проверено здесь и использовалось в качестве независимого метода для подтверждения интерпретации данных диффузии с точки зрения надмолекулярных комплексов AQP4. Однако, хотя BN-PAGE технически прост, использование детергентов препятствует значимому количественному определению доли AQP4, которая накапливается в OAP.Как видно на фиг. 2F, даже в клетках, трансфицированных AQP4-M23, где известно, что почти весь AQP4 заблокирован в OAP, значительная полоса тетрамера видна в иммуноблоте. Хотя детергент доцецилмальтозид относительно неденатурирует, он, по-видимому, солюбилизирует фракцию OAP, что приводит к появлению полосы тетрамера, хотя на самом деле в интактных клеточных мембранах присутствует очень мало индивидуальных тетрамеров. SPT предоставляет количественную информацию о содержании OAP в реальном времени в живых клетках, избегая артефактов фиксации или детергентов.Это позволило нам количественно изучить многие мутанты и химеры AQP4 более эффективно, чем это возможно с помощью альтернативных методов, потому что эксперименты проходят быстро, и от маркировки до сбора данных требуется всего 30-45 минут. TIRFM на сильно меченых клетках — это метод с относительно низким разрешением по сравнению с SPT, но его преимуществом является возможность визуализировать интактные клетки для определения пространственного распределения меченых белков по всей мембране. В сочетании эти методы флуоресценции обеспечивают мощный инструмент для выяснения природы AQP4 OAP.Следует отметить, что использование внешних эпитопов было решающим в этих исследованиях, потому что добавления на N- или C-конце AQP4 значительно изменяют его поведение. Химеры GFP-AQP1 и GFP-AQP2 успешно использовались нашей лабораторией в прошлом (Umenishi et al., 2000), а химеры GFP-AQP4 описаны в других исследованиях (Zelenina et al., 2002). Мы попытались использовать N-концевую химеру GFP-AQP4-M23, но обнаружили, что она свободно диффундирует в мембрану (наши неопубликованные наблюдения), что указывает на разрушение OAP с помощью фрагмента GFP.В дополнение к N-концу, как подробно обсуждается ниже, C-концевой PDZ-связывающий домен, вероятно, участвует в нацеливании или закреплении OAP на цитоплазматических партнерах по связыванию (Amiry-Moghaddam et al., 2004; Crane et al., 2008 ).
Рис. 5.AQP1 формирует OAP после замены своего N-концевого домена доменом AQP4-M23. (A) Выравнивание последовательностей первых 20 остатков AQP4-M23 и первых 18 остатков AQP1. Красным и желтым цветом выделены идентичные и консервативные остатки соответственно.Синие и желтые прямоугольники представляют начало трансмембранных доменов AQP4 и AQP1, соответственно, согласно опубликованным структурам. (B) Кристаллическая структура AQP1 (de Groot et al., 2001) (желтый) показана с добавлением девяти N-концевых остатков от AQP4-M23 (синий), образуя AQP1ch2. Ниже представлена схема различных химер AQP4-AQP1, показывающая относительный вклад AQP4 (синий) и AQP1 (желтый), с числами, указывающими начальный и конечный остатки, взятые из каждого белка, и названия химер, перечисленные справа.(C) P (диапазон) химер AQP4-AQP1: AQP1ch2 (красный), AQP1ch3 (зеленый), AQP1ch4 (темно-синий), AQP1ch5 (голубой), ch2-F26Q (оранжевый), AQP4-M23 (черный) и AQP1 (серый). (D) Расчетный процент указанных AQP и химер в OAP.
Гидрофобные взаимодействия с участием остатков Ala25 и Phe26 имеют большое влияние на образование OAP. Последовательное уменьшение гидропатии путем мутации Phe26 в аланин, а затем глутамина или мутации Ala25 в серин и глутамин приводило к последовательному снижению содержания OAP (рис.4). Конечно, эффективная гидропатия остатка зависит от окружающей его среды. Поэтому может быть более полезным рассмотреть общую гидропатию N-конца. Наши данные свидетельствуют о существовании в этой области низких и высоких «порогов» гидропатии, за пределами которых дальнейшие изменения не влияют на формирование ОАП. Например, Ala25 фланкирован Val24 и Phe26, поэтому, хотя он сам по себе не является чрезмерно гидрофобным, он находится в высокогидрофобной области (рис. 4A). Мутация в объемный лейцин в этом положении увеличивает местную гидропатию выше эффективного порога и снижает образование OAP, вероятно, из-за дефектов упаковки, связанных с повышенными стерическими препятствиями.На другом конце спектра тройной мутант по глутамину M23-V24Q / A25Q / F26Q не более нарушал образование OAP, чем глютаминовые мутации Phe26 или Ala25 по отдельности, что указывает на то, что одиночная мутация в любом сайте снижает гидропатию нижележащего домена. эффективный порог. Дальнейшие мутации в Phe26 указывают на то, что гидропатия — не единственный фактор, определяющий стабильность OAP. Например, замена лизина была менее эффективна в нарушении OAP, чем глутамин или глутамат, даже если учесть, что его гидропатия аналогична низкой по большинству шкал (Kyte and Doolittle, 1982; White and Wimley, 1999).Кроме того, консервативная замена Phe26 на более полярный остаток тирозина приводит к еще более жесткому, возможно гиперстабильному OAP (Fig. 4F), указывая тем самым, что объемная ароматическая структура в этом положении более важна для стабильности OAP, чем гидропатия.
По крайней мере, семь остатков перед Met23 необходимы для полного нарушения образования OAP (Figs 2 and 3). Никакая одиночная мутация в N-концевом домене AQP4-M1 не могла предотвратить нарушение OAP (Fig. 3A, B). Мы обнаружили, что мутант без пальмитоилирования (M1-C13A / C17A) не диффундировал иначе, чем AQP4-M1 дикого типа, что указывает на то, что предотвращение OAP в AQP4-M1 не требует пальмитоилирования (рис.3А). Эти результаты не согласуются с недавно опубликованными, в которых обнаружено, что> 90% M1-C13A / C17A связаны с OAP (Suzuki et al., 2008). Нам неизвестны причины разницы в наших результатах и результатах Suzuki и соавторов, хотя мы отмечаем, что другие добавки полипептида, не содержащего цистеина, в конце AQP4-M23 также были способны полностью предотвратить образование OAP. Из множества протестированных нами полипептидных последовательностей только полиглутамин оказался неэффективным при нарушении OAP (рис.3E). Следовательно, точная последовательность разрушающего домена в AQP4-M1 не важна, при условии, что он частично неполярен. Это могло бы объяснить, почему консервативность последовательности в первых 22 аминокислотах AQP4-M1 относительно низкая (72% идентичности между крысой и человеком) по сравнению со всей молекулой AQP4-M23 (96% идентичности между крысой и человеком). Наши данные свидетельствуют о том, что конкурентное аутоингибирование гидрофобных взаимодействий нарушает межмолекулярные контакты рядом с Met23 и отвечает за различное поведение изоформ M1 и M23 AQP4.
Усекающие мутации и сайт-направленный мутагенез AQP4-M23 предполагают, что четыре самых N-концевых остатка AQP4-M23 (Met-Val-Ala-Phe) образуют ключевой гидрофобный домен, ответственный за образование OAP. Однако наши результаты показывают, что другие остатки рядом с N-концом AQP4-M23 также участвуют. Во-первых, замена пролином гидрофильных остатков Lys27 и Gly28 полностью предотвращала образование OAP в AQP4-M23, тогда как замена аланином в тех же положениях не влияла (рис.4). Во-вторых, простого добавления четырех N-концевых остатков AQP4-M23 на конец AQP1, не образующего OAP гомолога AQP4, было недостаточно, чтобы индуцировать AQP1 для образования OAP. Мы обнаружили, что замена всего N-концевого цитоплазматического домена AQP1 (от Met1 до Lys8) на весь N-концевой домен AQP4-M23 (от Met23 до Thr31) была необходима для продукции AQP1 OAP (рис. 5). Более того, положение этих девяти остатков относительно исходного остатка первой трансмембранной спирали было решающим. Есть несколько возможных объяснений этих наблюдений.Интересная возможность состоит в том, что девять остатков в N-концевом домене AQP4-M23 образуют вторичный структурный элемент, который является критическим для образования OAP. Расстояние из четырех остатков между Trp30 и Phe26 указывает на возможность однооборотной амфипатической спирали, закрепленной на цитоплазматической поверхности мембраны с помощью этих ароматических остатков, которые благоприятствуют границе раздела липид-вода (White and Wimley, 1999). Введение остатка пролина между Trp30 и Phe26, безусловно, предотвратит образование короткой спирали и может объяснить полную потерю образования OAP.В опубликованной структуре AQP4-M23 N-концевой домен между Met23 и Gln32 оказался неструктурированным (Hiroaki et al., 2006), но авторы использовали N-концевую метку аффинной очистки 6 × His при приготовлении образцов. , что может нарушить любую вторичную структуру в этом регионе. В AQP4-M23 связывающий домен между Phe26 и первой трансмембранной спиралью (Lys-Gly-Val-Trp-Thr) имеет чистую гидропатию около нуля (рис. 4A) и содержит остатки, которые, вероятно, благоприятно разделяются на мембранную поверхность раздела. поддержание N-конца в ассоциированном с мембраной состоянии, при котором контакты тетрамер-тетрамер могут быть оптимальными.Пять остатков, примыкающих к первой трансмембранной спирали в AQP1 (Glu-Phe-Lys-Lys-Lys), составляют очень полярный участок пептида, который, в случае AQP1ch3, может вытеснять N-конец за пределы поверхности раздела мембран, вдали от идеального положения для гидрофобного взаимодействия. Исследования реконструированных модельных пептидов показали, что « гидрофобные карманы », созданные растворимыми N-концевыми доменами вблизи поверхности раздела мембран, могут стабилизировать олигомеризацию трансмембранных спиралей (Arluison et al., 2004).
Коалесценция тетрамеров AQP4 в плазматической мембране с OAP почти устраняет их латеральную подвижность на временной шкале в несколько секунд. Мы использовали сильно различающуюся диффузию мутантов AQP4 в OAP по сравнению с диффузией вне OAP, чтобы определить в живых клетках домены, участвующие в образовании и разрушении OAP. Наши данные показывают, что гидрофобное межмолекулярное взаимодействие на N-конце AQP4-M23 происходит вблизи границы раздела цитоплазматической мембраны, что приводит к образованию OAP.Это взаимодействие полностью нарушается остатками от Cys17 до Ser21 AQP4-M1; однако конкретная последовательность этого разрушающего домена не важна. Хотя наиболее вероятное объяснение этих и предыдущих экспериментов состоит в том, что тетрамеры AQP4 напрямую взаимодействуют с образованием OAPs, мы не можем формально исключить возможность того, что другие белки участвуют в образовании и / или разрушении OAP. Также остается определить, вызвана ли предотвращение OAP в AQP4-M1 прямым блокированием гидрофобного связывающего кармана возле Met23, смещением этого кармана из его оптимального положения или изменением необходимой вторичной структуры в этом сайте.
Материалы и методы
ДНК-конструкций
Плазмиды AQP1.T120.myc, AQP4M1.myc и AQP4M23.myc, которые кодируют изоформы AQP1 человека и AQP4 крысы, соответственно, и эпитоп Myc с десятью остатками (NH 2 -EQKLISEEDL-COOH) во второй внеклеточной петле генерировались ранее (Crane et al., 2008; Crane, Verkman, 2008). Все усечения AQP4, точечные мутанты и химеры AQP4-AQP1 были получены стандартными методами ПЦР с использованием указанных выше плазмид в качестве матриц.Все конструкции были полностью секвенированы.
Клеточные культуры и трансфекции
Клеточные культурыCOS-7 (ATCC CRL-1651) поддерживали при 37 ° C в 5% CO. 2 , 95% воздуха в среде DME-h31, содержащей 10% фетальной бычьей сыворотки, 100 Ед / мл пенициллина и 100 мкг / мл. мл стрептомицина. За шесть часов до трансфекции клетки переносили в 12-луночные планшеты, содержащие покровные стекла диаметром 18 мм, с использованием среды, не содержащей антибиотиков. Клетки трансфицировали с использованием липофектамина 2000 (Invitrogen, Carlsbad, CA) в соответствии с протоколом производителя за 24-48 часов до экспериментов.
Маркировка и обработка клеток
Перед маркировкой AQP квантовыми точками (Qdots) клетки промывали 3 мл PBS, содержащего 6 мМ глюкозы и 1 мМ пируват (буфер GP), и инкубировали в течение 5 минут в блокирующем буфере (буфер GP, содержащий 1% бычьего сывороточного альбумина). с последующими 5 минутами с 70 нг / мл мышиных антител против Myc (Covance, Emeryville, CA) в блокирующем буфере. Затем клетки промывали буфером GP, инкубировали в течение 5 минут с 0,1 нМ козьего F (ab ‘) 2 Qdot 655 (Invitrogen), конъюгированного с IgG мыши, в блокирующем буфере, затем снова промывали буфером GP.Покровные стекла переносили в специально изготовленную перфузионную камеру и поддерживали в буфере GP на протяжении всего эксперимента. В этих условиях мечения клетки, экспрессирующие AQP4 или AQP1, демонстрировали несколько ярких точек Q, тогда как неэкспрессирующие клетки были полностью темными без фона.
Для метки с высокой флуоресценцией, используемой в флуоресцентной микроскопии полного внутреннего отражения (TIRFM), клетки фиксировали в течение 10 минут 4% параформальдегидом, затем промывали PBS. Фиксированные клетки инкубировали в течение 30 минут в блокирующем буфере, затем в течение 1 часа с 1.4 мкг / мл антитела против Myc в блокирующем буфере. Клетки снова промывали PBS и инкубировали в течение 1 часа с 10 мкг / мл козьего F (ab ‘) 2 , конъюгированного с IgG мыши Alexa Fluor 555 (Invitrogen) в блокирующем буфере. Затем клетки тщательно промывали в PBS, и покровные стекла закрывали жестко закрепленной средой VectaMount для микроскопии (Vector Laboratories, Burlingame, CA).
Приборы и измерения для микроскопии
SPT выполняли на инвертированном эпифлуоресцентном микроскопе Nikon Eclipse TE2000S (Nikon, Мелвилл, Нью-Йорк), оборудованном масляно-иммерсионным объективом Nikon × 100 TIRF (числовая апертура 1.45) и камера CCD с глубоким охлаждением (Hamamatsu EM-CCD, Bridgewater, NJ). Флуоресценцию Qdot возбуждали с использованием возбуждающего фильтра E460SPUV и дихроичного зеркала 475DCXRU и детектировали через эмиссионный фильтр D655 / 40m (Chroma, Rockingham, VT). Данные получали непрерывно с частотой 11 миллисекунд на кадр (91 Гц) в течение 6 секунд при 37 ° C в течение 30 минут после последней стадии промывки. Пространственное разрешение системы, определенное из s.d. координат x , y иммобилизованных Q-точек на покровном стекле (Fujiwara et al., 2002), составляла 18 нм при 91 Гц. Ранее мы продемонстрировали, используя анализ интенсивности кластерных пикселей сильно меченых клеток, трансфицированных AQP4, что приблизительно один сэндвич с первичным и вторичным антителами маркирует каждый тетрамер AQP4 в нашей системе (Crane et al., 2008). Вероятно, это происходит из-за стерических препятствий, не позволяющих множественным антителам получить доступ к более чем одному эпитопу Myc в одном тетрамере. Прерывистое мигание до фонового уровня подтвердило, что отслеживались только отдельные точки Qdots.
TIRFM был выполнен с использованием микроскопа Nikon Eclipse TE2000E со сквозным объективом TIRF и масляно-иммерсионным объективом TIRF × 100 (числовая апертура 1.49), установленный на модуле идеальной фокусировки (Nikon). Ионно-аргоновый лазер (Spectra Physics, Маунтин-Вью, Калифорния) на заказном запуске был подключен через оптоволокно к модулю TIRF. AQP4, меченный Alexa Fluor 555, возбуждали с помощью фильтра возбуждения Z514 / 10x и дихроичного зеркала Z514RDC и детектировали через фильтр излучения D605 / 40m (Chroma). Изображения получали с помощью камеры CCD с глубоким охлаждением QuantEM 512SC (Photometrics, Tucson, AZ).
Анализ SPT
Было проанализированопоследовательностей изображений и построены траектории с использованием программного обеспечения IDL (Research Systems, Боулдер, Колорадо) с алгоритмами, доступными в виде условно-бесплатного ПО на сайте www.Physics.emory.edu/faculty/weeks/idl/. При построении траектории учитывалось мерцание отдельных Qdot. Траектории считались непрерывными, если мигающая точка Qdot была повторно обнаружена в пределах 4-пиксельного радиуса и 20-кадрового окна. Среднеквадратичное смещение (MSD) как функция времени 〈 r 2 ( t )〉 было построено для каждой траектории, а коэффициент диффузии D 1-3 и смещение (из-за шума) были определены путем линейной аппроксимации первых трех временных шагов МСД: (1) смещение было вычтено из каждой точки, и первые 25% кривой (Saxton, 1997) были подогнаны с использованием взвешенного нелинейного наименьшего алгоритм подбора квадратов для комбинированной квадратичной, полиномиальной и экспоненциальной функции (Haggie et al., 2006) с подгоночными параметрами a 1 , a 2 , a 3 ≥0, так что 〈 r 2 ( t )〉 соответствует = a 1 t 2 + a 2 [1 – exp (- a 3 t )]. Подгонка была взвешена по дисперсии MSD на каждом временном шаге. (2)
Данные о диффузии в основном представлены в виде совокупного распределения диапазонов за 1 секунду (рис.1D), где P (диапазон) определяется как вероятность того, что диапазон частицы меньше или равен заданному расстоянию при t = 1 секунда. Были проанализированы только траектории длиной более 200 шагов с наборами данных, состоящими из не менее 200 траекторий как минимум из 15 ячеек. Статистическая значимость различий средних значений диапазона определялась с помощью теста Стьюдента t . На основании открытия, что ~ 95% AQP4 присутствует в OAP в клетках, экспрессирующих AQP4-M23 (Furman et al., 2003; Suzuki et al., 2008) и пространственное разрешение 18 нм для нашей системы SPT, мы оценили процентное содержание AQP4 в OAP для различных мутантов как P (79 ± 18 нм), диапазон, при котором P ( диапазон) = 0,95 для AQP4-M23. Эти оценки представлены в виде гистограмм на рис. 2, 3, 4, 5 с нижним и верхним крайними значениями планок ошибок, равными P (61 нм) и P (97 нм), соответственно.
Электрофорез и иммуноблот-анализ
Трансфицированные клетки лизировали буфером для образцов NativePAGE, содержащим 1% додецил-β-D-мальтозид (DDM), в течение 10 минут на льду.Все материалы были приобретены у Invitrogen, если не указано иное. Лизат центрифугировали при 20000 g в течение 30 минут при 4 ° C и осадок отбрасывали. Общее содержание белка определяли методом Брэдфорда. Для Blue-Native PAGE 10 мкг белка смешивали с Coomassie G-250 при соотношении DDM: Coomassie 4: 1, загружали на 3% -12% Bis-Tris гель NativePAGE вместе с маркерами молекулярной массы NativeMARK и запускали с NativePAGE работает с буферами в соответствии с протоколом производителя.Для SDS-PAGE те же клеточные лизаты денатурировали буфером для образцов NuPAGE LDS и восстанавливающим агентом, загружали в гель NuPAGE 12% Bis-Tris вместе с маркерами молекулярной массы SeeBlue Plus2 и обрабатывали с рабочим буфером NuPAGE MES SDS при 100 В. Белки наносили на мембраны из ПВДФ. После переноса нативные белки фиксировали путем вымачивания мембран в течение 15 минут в 8% уксусной кислоте и обесцвечивали метанолом. Мембраны блокировали 5% обезжиренным молоком и инкубировали в течение ночи с 0,7 мкг / мл первичного антитела против Myc при 4 ° C.Затем мембраны промывали, инкубировали в течение 1 часа с козьим антимышиным IgG, конъюгированным с пероксидазой хрена (Bio-Rad Laboratories, Геркулес, Калифорния), тщательно промывали и детектировали меченые белки с помощью набора для ферментной хемилюминесценции ECL Plus (Amersham).
Footnotes
Эта работа была поддержана грантами NIH DK35124, EB00415, HL73856, HL59198, EY13574 и DK72517, а также грантами на Программу развития исследований и открытие лекарств от Фонда кистозного фиброза.J.M.C. была частично поддержана наградой NIH NRSA GM808512. Депонируется в ЧВК для выпуска через 12 месяцев.
Дополнительные материалы доступны в Интернете по адресу http://jcs.biologies.org/cgi/content/full/122/6/813/DC1
- Принято 17 ноября 2008 г.
- © Компания Биологи Лимитед 2009
Ссылки
- ↵
Амири-Могаддам, М., Фриденлунд, Д. С. и Оттерсен, О. П. (2004). Закрепление аквапорина-4 в мозге: молекулярные механизмы и последствия для физиологии и патофизиологии водного транспорта. Неврология 129, 999-1010.
- ↵
Арлюисон В., Сеген Дж., Ле Каер Дж. П., Стерджис Дж. Н. и Роберт Б. (2004). Гидрофобные карманы на границе раздела мембран: оригинальный механизм взаимодействия мембранных белков. Биохимия 43, 1276-1282.
- ↵
Крейн, Дж.М. и Веркман А.С. (2008). Дальнодействующая неаномальная диффузия меченных квантовыми точками водных каналов аквапорина-1 в плазматической мембране клетки. Биофиз. J. 94, 702-713.
- ↵
Крейн, Дж. М., Ван Хук, А. Н., Скач, В. Р. и Веркман, А. С. (2008). Динамика аквапорина-4 в ортогональных массивах в живых клетках, визуализированная с помощью отслеживания одиночных частиц с помощью квантовой точки. Мол. Биол. Cell 19, 3369-3378.
- ↵
де Гроот, Б.Л., Энгель А. и Грубмюллер Х. (2001). Уточненная структура человеческого аквапорина-1. FEBS Lett. 504, 206-211.
- ↵
Эллисман М. Х., Раш Дж. Э., Стахелин Л. А. и Портер К. Р. (1976). Исследования возбудимых оболочек. II. Сравнение специализаций в нервно-мышечных соединениях и несоединительных сарколеммах быстрых и медленных мышечных волокон млекопитающих. J. Cell Biol. 68, 752-774.
- ↵
Фригери, А., Гроппер, М.А., Умениши, Ф., Кавашима, М., Браун, Д. и Веркман, А.С. (1995). Локализация гомологов водных каналов MIWC и GLIP в нервно-мышечной, эпителиальной и железистой тканях. J. Cell Sci. 108, 2993-3002.
- ↵
Fujiwara, T., Ritchie, K., Murakoshi, H., Jacobson, K. и Kusumi, A. (2002). Фосфолипиды подвергаются диффузии хмеля в клеточной мембране, разделенной на отдельные части. J. Cell Biol. 157, 1071-1081.
- ↵
Фурман, К.С., Горелик-Фельдман, Д. А., Дэвидсон, К. Г., Ясумура, Т., Нили, Дж. Д., Агре, П. и Раш, Д. Е. (2003). Сборка квадратной матрицы Аквапорин-4: противодействие изоформ M1 и M23. Proc. Natl. Акад. Sci. USA 100, 13609-13614.
- ↵
Хэгги П., Ким Дж., Лукач Г. и Веркман А. (2006). Отслеживание CFTR, меченного квантовыми точками, показывает почти иммобилизацию за счет С-концевых взаимодействий PDZ. Мол. Биол. Cell 17, 4937-4945.
- ↵
Хасегава, Х., Ма, Т., Скач, В., Маттей, М.А. и Веркман, А.С. (1994). Молекулярное клонирование нечувствительного к ртути водного канала, выраженного в выбранных тканях, транспортирующих воду. J. Biol. Chem. 269, 5497-5500.
- ↵
Хаттон, Дж. Д. и Эллисман, М. Х. (1982). Распределение ортогональных массивов в среднем возвышении крысы с замороженными трещинами. J. Neurocytol. 11, 335-349.
- ↵
Хаттон, Дж.Д., Кокс, Г. Ф., Миллер, А. Л., Никол, Дж. А. и Эллисман, М. Х. (1987). Идентификация полипептидов, связанных с везикулами сарколеммы, обогащенными ортогональными массивами. Биохим. Биофиз. Acta 904, 373-380.
- ↵
Хироаки, Ю., Тани, К., Камегава, А., Гёбу, Н., Нисикава, К., Судзуки, Х., Вальц, Т., Сасаки, С., Мицуока, К., Кимура, K. et al. (2006). Влияние структуры аквапорина-4 на формирование массива и адгезию клеток.J. Mol. Биол. 355, 628-639.
- ↵
Юнг, Дж. С., Бхат, Р. В., Престон, Г. М., Гуджино, В. Б., Барабан, Дж. М. и Агре, П. (1994). Молекулярная характеристика кДНК аквапорина головного мозга: кандидат в осморецептор и регулятор водного баланса. Proc. Natl. Акад. Sci. USA 91, 13052-13056.
- ↵
Кайт, Дж. И Дулиттл, Р. Ф. (1982). Простой метод отображения гидропатического характера протеина.J. Mol. Биол. 157, 105-132.
- ↵
Лэндис, Д. М. и Риз, Т. С. (1974). Массивы частиц в мембранах астроцитов с трещинами при замораживании. J. Cell Biol. 60, 316-320.
- ↵
Лу, М., Ли, М. Д., Смит, Б. Л., Юнг, Дж. С., Агре, П., Вердейк, М. А., Мерк, Г., Райсс, Дж. П. и Дин, П. М. (1996). Ген AQP4 человека: определение локуса, кодирующего полипептиды двух водных каналов в головном мозге.Proc. Natl. Акад. Sci. USA 93, 10908-10912.
- ↵
Лу Ю., Тернбулл И. Р., Брагин А., Карвет К., Веркман А. С. и Скач В. Р. (2000). Переориентация топологии аквапорина-1 во время созревания в эндоплазматическом ретикулуме. Мол. Биол. Cell 11, 2973-2985.
- ↵
Мо, С. Э., Сорбо, Дж. Г., Согаард, Р., Цойтен, Т., Петтер Оттерсен, О. и Холен, Т. (2008). Новые изоформы Аквапорина-4 крысы.Genomics 91, 367-377.
- ↵
Нили, Дж. Д., Кристенсен, Б. М., Нильсен, С. и Агре, П. (1999). Гетеротетрамерный состав водных каналов аквапорин-4. Биохимия 38, 11156-11163.
- ↵
Орчи Л., Гумберт Ф., Браун Д. и Перрелет А. (1981). Ультраструктура мембран мочевых канальцев. Int. Rev. Cytol. 73, 183–242.
- ↵
Раш, Дж.E., Staehelin, L.A. и Ellisman, M.H. (1974). Прямоугольные массивы частиц на плазматических мембранах с замораживанием не являются щелевыми контактами. Exp. Cell Res. 86, 187–190.
- ↵
Rash, J. E., Yasumura, T., Hudson, C. S., Agre, P. and Nielsen, S. (1998). Прямая иммуно-золотая маркировка аквапорина-4 в квадратных массивах плазматических мембран астроцитов и эпендимоцитов в головном и спинном мозге крыс. Proc. Natl. Акад. Sci. USA 95, 11981-11986.
- ↵
Saxton, M. (1997). Одночастичное слежение: распределение коэффициентов диффузии. Биофиз. J. 72, 1744–1753.
- ↵
Schotland, D. L., Bonilla, E. and Wakayama, Y. (1981). Исследования замораживания перелома мышечной плазматической мембраны при мышечной дистрофии человека. Acta Neuropathol 54, 189–197.
- ↵
Зильберштейн, К., Боули, Р., Хуанг, Ю., Фанг, П., Пастор-Солер, Н., Браун, Д. и Ван Хук, А. Н. (2004). Мембранная организация и функция изоформ M1 и M23 аквапорина-4 в эпителиальных клетках. Являюсь. J. Physiol. Renal Physiol. 287, F501-F511.
- ↵
Сорбо Дж. Г., Мо С. Э., Оттерсен О. П. и Холен Т. (2008). Молекулярный состав квадратных массивов. Biochemistry 47, 2631-2637.
- ↵
Suzuki, H., Нисикава, К., Хироаки, Ю. и Фудзиёси, Ю. (2008). Формирование массивов аквапорина-4 ингибируется пальмитоилированием N-концевых остатков цистеина. Биохим. Биофиз. Acta 1778, 1181–1189.
- ↵
Умениши, Ф., Вербавац, Дж. М. и Веркман, А. С. (2000). цАМФ регулирует мембранную диффузию зеленой флуоресцентной химеры белок-аквапорин 2. Биофиз. J. 78, 1024-1035.
- ↵
Ван Хук, А.Н., Ма, Т., Янг, Б., Веркман, А.С. и Браун, Д. (2000). Аквапорин-4 экспрессируется в базолатеральных мембранах проксимальных сегментов S3 канальцев в почках мыши. Являюсь. J. Physiol. Renal Physiol. 278, F310-F316.
- ↵
Вербавац, Дж. М., Ван Хук, А. Н., Ма, Т., Саболич, И., Валенти, Г., Эллисман, М. Х., Аузиелло, Д. А., Веркман, А. С. и Браун, Д. (1994). Сарколеммальный антиген 28 кДа в базолатеральных мембранах основных клеток почек: связь с ортогональными массивами и MIP26.J. Cell Sci. 107, 1083-1094.
- ↵
Вербавац, Дж. М., Ма, Т., Гобин, Р. и Веркман, А. С. (1997). Отсутствие ортогональных массивов в почках, головном мозге и мышцах у трансгенных мышей с нокаутом, лишенных водного канала аквапорина-4. J. Cell Sci. 110, 2855-2860.
- ↵
White, S.H. и Wimley, W.C. (1999). Сворачивание и стабильность мембранного белка: физические принципы. Анну. Rev. Biophys.Biomol. Struct. 28, 319-365.
- ↵
Wolburg, H. (1995). Ортогональные массивы внутримембранозных частиц: обзор со специальной ссылкой на астроциты. J. Hirnforsch. 36, 239–258.
- ↵
Янг Б., Браун Д. и Веркман А. С. (1996). Нечувствительный к ртути водный канал (AQP-4) образует ортогональные массивы в стабильно трансфицированных клетках яичников китайского хомячка. J. Biol. Chem.271, 4577-4580.
- ↵
Янг Б., Ван Хук А. Н. и Веркман А. С. (1997). Очень высокая одноканальная водопроницаемость аквапорина-4 в инфицированных бакуловирусом клетках насекомых и липосомах, восстановленных очищенным аквапорином-4. Биохимия 36, 7625-7632.
- ↵
Зеленина М., Зеленин С., Бондарь А.А., Брисмар Х. и Аперия А. (2002). Водопроницаемость аквапорина-4 снижается протеинкиназой С и дофамином.Являюсь. J. Physiol. Renal Physiol. 283, F309-F318.
Страница не найдена
ДокументыМоя библиотека
раз- Моя библиотека

