Калькулятор расчета разбавления раствора онлайн
Разбавление раствора — это процесс уменьшения концентрации вещества при помощи добавления растворителя. Количество вещества при разбавлении растворов остается постоянным.
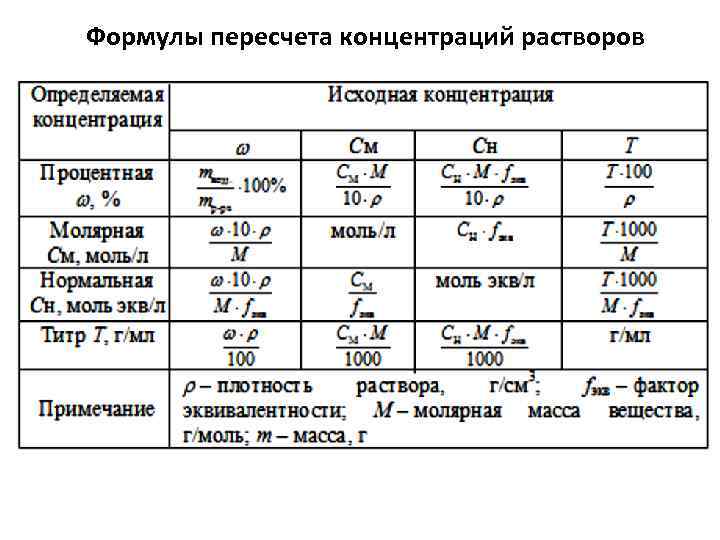
Концентрация растворов
В химической практике обычно приходится работать с растворами строгой концентрации. Например, приготовление лекарственных растворов требует строго заданного количества действующего вещества, иначе не будет достигнут лечебный эффект или раствор будет вреден для здоровья. Также большая часть химических реакций проводится в растворах, а для корректного протекания реакции требуется использовать вещества строгой концентрации. Одна ошибка — и реакция выйдет из-под контроля, и хорошо еще, если не нанесет вред химику и его имуществу.
Именно поэтому всегда указывается концентрация участвующих в реакции веществ. Одним из способов указания насыщенности растворов — это массовая доля, которая представляет собой массу растворенного вещества к общей массе раствора. Формула массовой доли выглядит следующим образом:
Формула массовой доли выглядит следующим образом:
w = (m1 / m) × 100%,
где m1 — масса активного вещества, m — масса раствора.
Например, маринад для домашней капусты представляет собой раствор, который готовится по рецепту: 10 г поваренной соли на 1 литр воды. На первый взгляд кажется, что такой маринад имеет концентрацию соли в 1%, однако это не так. Если к 1 литру чистой воды, который весит 1000 г, добавить 10 г соли, то масса раствора составит 1,01 кг. Следовательно, концентрация маринада составит:
w = 10 / 1010 = 0,9%
Разница невелика, но в химических опытах такое различие может сыграть решающую роль. Поэтому при приготовлении растворов по рецептам из химических справочников вначале добавляют в мензурку действующее вещество, а затем доливают растворитель до заданной отметки.
Массовая концентрация вещества также носит название процентной концентрации, однако в некоторых случаях гораздо удобнее пользоваться другой мерой насыщенности — молярной концентрацией.
Молярная концентрация
При разбавлении раствора изменяется его объем и концентрация, но количество вещества остается статичным. Моль в химии — это количества вещества, в котором присутствует 6,022 × 1023 структурных частиц. Такое значение выбрано не случайно. Итальянский химик Амадео Авогадро принял моль в качестве единицы измерения, но не задавал для него определенного количества: он лишь знал, что это количество несоизмеримо большее. Позднее нобелевский лауреат Жан Батист Перрен задал для моля количество вещества, равное количеству атомов, которое содержится в 12 граммах изотопа углерод-12.
Молярная масса — это масса одного моля химического вещества, которое легко определяется по таблице Менделеева: достаточно суммировать атомные массы элементов, входящих в состав соединения. Например, 1 моль кислорода O2 имеет массу 32 грамма, так как каждый атом кислорода характеризуется атомной массой в 16 единиц.
Молярная концентрация — это количество молей активного вещества на 1 литр раствора. Представим, что в колбу добавлено 790 грамм марганцовки. Перманганат калия, он же марганцовка, имеет формулу KMnO4. Молярная масса вещества рассчитывается как сумма атомных масс элементов: 39 + 55 + 16 × 4 = 158 г/моль. Таким образом, в колбу добавлено 790 / 158 = 5 моль перманганата калия. Если мы добавим в колбу дистиллированную воду ровно до отметки 2 л, то получим раствор перманганата калия с концентрацией 2,5М или 2,5 моль/литр.
Представим, что в колбу добавлено 790 грамм марганцовки. Перманганат калия, он же марганцовка, имеет формулу KMnO4. Молярная масса вещества рассчитывается как сумма атомных масс элементов: 39 + 55 + 16 × 4 = 158 г/моль. Таким образом, в колбу добавлено 790 / 158 = 5 моль перманганата калия. Если мы добавим в колбу дистиллированную воду ровно до отметки 2 л, то получим раствор перманганата калия с концентрацией 2,5М или 2,5 моль/литр.
А теперь представим, что в колбу добавлено 360 г соляной кислоты. Один моль соляной кислоты имеет массу 36 г, следовательно, в колбу добавлено 10 моль вещества. Плотность хлористого водорода составляет 1,19 г/см³, следовательно, кислота занимает объем:
360 / 1,19 = 302,5 см³ или 0,3025 литра
Если добавим в колбу дистиллированную воду до отметки 2 литра, то получим раствор 5М. Но если заранее отмерить 2 литра воды и влить их в колбу, то молярная концентрация раствора изменится, так как теперь в колбе не 2 л раствора, а 2,3025 литра. Следовательно, молярная концентрация такого раствора составляет 10/2,3025 = 4,34 моль/литр.
Во избежание подобных казусов используется моляльная концентрация — количество растворенного вещества на 1 кг растворителя. Так как мы добавляли воду, то 2 л воды имеет массу 2 кг, следовательно, моляльная концентрация соляной кислоты составит 5м. В случае использования других растворителей (уайт-спирит, ацетон, скипидар) вначале потребовалось бы вычислить их массу по формуле:
m = V × p,
где p — плотность растворителя.
Если добавить еще больше растворителя, то молярная и моляльные концентрации снизятся.
Калькулятор разбавления растворов
Полученные выше растворы легко разбавлять при помощи растворителей или растворов меньшей концентрации. Разбавление происходит по простой формуле:
M1 × V1 = M2 × V2,
где M1 и V1 — концентрация и объем раствора до разбавления, а M2 и V2 — после разбавления.
Данная формула заложена в наш онлайн-калькулятор, при помощи которого легко рассчитать полученный раствор после разбавления и количество необходимого растворителя.
Пример из реальной жизни
Разбавление раствора
Пусть есть 2 литра раствора этанола с концентрацией 5М. Сколько нужно добавить дистиллированной воды, чтобы концентрация раствора снизилась до 1М? Итак, у нас есть все необходимые данные для расчета — их достаточно добавить в соответствующие ячейки калькулятора и получить ответ:
- Объем после разбавления (V2): 5,0000 L
- Объем добавленного растворителя (V): 3,0000 L
Заключение
Разбавление растворов — типичная задача не только в лаборатории, но и на кухне, в быту или профессиональной деятельности. Разбавлять концентрированные растворы веществ приходится поварам, аптекарям, уборщикам, автомобилистам, парфюмерам и представителям многих других профессий. Используйте наш калькулятор для проверки своих расчетов.
Онлайн калькулятор: расчет цементного раствора и бетона
Калькулятор предназначен для быстрого расчета цементно-песчаного раствора или бетона на основании используемой марки цемента.
Ниже калькулятора приведены таблицы состава цементно-известковых, цементно-глиняных и цементных растворов для каменных конструкций и расхода цемента из расчета кг на 1 м³ песка (раствора).
Ознакомьтесь также со статьями о марках цемента и о марках бетона.
Калькулятор расчета бетона
Начинайте вводить цифры, калькулятор произведет расчет автоматически.
| Объем раствора: | м3 |
| Марка раствора: | М25М50М75М100 |
| Итог: | |
| Цемент: | 0 |
| Песок: | 0 |
| Вода: | 0 |
Ниже — пару вспомогательных таблиц.
Составы цементно-известковых, цементно-глиняных и цементных растворов для каменных конструкций
| Марка цемента | Объемная дозировка (цемент: известь или глина: песок) для растворов марок | |||||
| 150 | 100 | 75 | 50 | 10 | ||
| 400 | 1 : 0,2 : 3 1 : 0 : 3 | 1 : 0,4 : 4,5 1 : 0 : 4,5 | 1 : 0,5 : 5,5 1 : 0 : 5,5 | 1 : 0,9 : 8 | — | — |
| 300 | 1 : 0,1 : 2,5 1 : 0 : 2,5 | 1 : 0,2 : 3,5 1 : 0 : 3 | 1 : 0,3 : 0,4 1 : 0 : 4 | 1 : 0,6 : 6 1 : 0 : 6 | 1 : 1 : 10,5 1 : 1 : 9 | — |
| 200 | — | — | 1 : 0,1 : 2,5 1 : 0 : 2,5 | 1 : 0,3 : 4 1 : 0 : 4 | 1 : 0,8 : 7 — | 1 : 1 : 9 1 : 0,8 : 7 |
Расход цемента, кг на 1 м³ песка (раствора)
| Марка цемента | Марка раствора | |||||
| 150 | 100 | 75 | 50 | 25 | 10 | |
| 400 300 200 | 350 400 470 — | 255 300 340 — | 200 240 270 405 | 140 175 185 280 | — 105 155 | — — 75 |
Выберите подписку
Все планы включают калькулятор алгебры, уроки, практику и отсутствие рекламы.
Ежемесячно
$9,99 /месяцКупить
Скидка 50%!
Ежегодно
4,99 доллара США /месяц(59,88 долларов США в год)
Пошаговые пояснения к домашним заданиям
Получите мгновенную непрерывную помощь с простыми для понимания объяснениями при решении сложных уравнений.
Просто введите уравнение, и оно рассчитает ответ. Мало того, это приложение также дает вам пошаговое объяснение того, как найти ответ! Чрезвычайно полезно .
..
A.J.B
Премиум-уроки по алгебре
Исследуйте интерактивные уроки, смотрите видео и читайте дальше, чтобы лучше понять математическую задачу, над которой вы работаете.
Основы алгебры еще никогда не были для меня такими понятными. Ваш метод сработал как никто другой.
Дон Д.
Непрерывный доступ к бесконечным практическим задачам
Оттачивайте свои навыки с помощью наших автоматически создаваемых практических задач. Практикуйтесь столько, сколько хотите по каждой теме.
Мне 79 лет, и я нахожу это отличным упражнением для мозга. В школе я очень плохо учился по алгебре.
Чарльз Дж.
Не позволяйте алгебре стоять у вас на пути. Сокруши его с MathPapa!
Премиальный план Алгебра калькулятор
Практические задачи
Уроки
Нет рекламы
Общие вопросы
900Улучшу ли я алгебру?
Мы максимально упрощаем понимание алгебры быстро.
Что, если я передумаю?
Без проблем. Вы можете получить полный возврат средств без вопросов в течение 7 дней с момента первоначальной покупки, связавшись с нами напрямую. И вы всегда можете отменить подписку в настройках своей учетной записи. Итак, получите премиум сегодня!
Будет ли мое приложение для iOS или Android также обновлено?
Да, вы можете войти в мобильное приложение с помощью своей обновленной веб-учетной записи, чтобы получить доступ к премиум-приложению.
Больше вопросов?
Свяжитесь с нами
Калькулятор растворов в процентах (%) — PhysiologyWeb
Калькулятор растворов в процентах (%)
Этот калькулятор (см. ниже) предназначен для использования как в учебной, так и в исследовательской лаборатории. различных расчетов для подготовки
ниже) предназначен для использования как в учебной, так и в исследовательской лаборатории. различных расчетов для подготовки
Поскольку процентные растворы могут быть выражены тремя различными способами, необходимо явно указать тип процентного раствора. Если эта информация не предоставлена, конечному пользователю остается «угадать», использовалось ли % вес/об, % вес/вес или % объем/объем. Каждый процентный раствор подходит для ряда различных приложений. Например, коммерческие водные реагенты, такие как концентрированные кислоты и основания, обычно выражают в виде растворов в процентах по массе. Например, коммерчески доступная концентрированная соляная кислота (HCl) составляет 37% по весу (мас./мас.%). С другой стороны, многие разбавленные растворы, используемые для биологических исследований, выражаются в % массы/объема (например, 1% додецилсульфат натрия, SDS). Объемные/объемные % растворенных веществ также распространены и используются, когда используются чистые растворенные вещества в жидкой форме. Например, 70 % (об./об.) раствор этанола можно приготовить путем растворения 70 мл 100 % (т. е. пробы 200) этанола в общем объеме раствора 100 мл.
Если эта информация не предоставлена, конечному пользователю остается «угадать», использовалось ли % вес/об, % вес/вес или % объем/объем. Каждый процентный раствор подходит для ряда различных приложений. Например, коммерческие водные реагенты, такие как концентрированные кислоты и основания, обычно выражают в виде растворов в процентах по массе. Например, коммерчески доступная концентрированная соляная кислота (HCl) составляет 37% по весу (мас./мас.%). С другой стороны, многие разбавленные растворы, используемые для биологических исследований, выражаются в % массы/объема (например, 1% додецилсульфат натрия, SDS). Объемные/объемные % растворенных веществ также распространены и используются, когда используются чистые растворенные вещества в жидкой форме. Например, 70 % (об./об.) раствор этанола можно приготовить путем растворения 70 мл 100 % (т. е. пробы 200) этанола в общем объеме раствора 100 мл.
При выборе типа процентного раствора для приготовления могут иметь значение и другие факторы. Например, если рассматриваемый процентный раствор должен использоваться при самых разных температурах, то лучше приготовить раствор в виде раствора в процентах по массе, поскольку его концентрация не зависит от изменений температуры окружающей среды.
Например, если рассматриваемый процентный раствор должен использоваться при самых разных температурах, то лучше приготовить раствор в виде раствора в процентах по массе, поскольку его концентрация не зависит от изменений температуры окружающей среды.
Важное примечание. Здесь мы использовали «вес» вместо «масса» просто для того, чтобы соответствовать традиции и популярному использованию. Таким образом, 9Растворы 0007 % масса/объем должны правильно называться % масса/объем . Аналогично, растворы масс./масс.% следует обозначать как масс./масс.% или просто масс.% .
Если вы хотите выполнить расчеты разведения для растворов с молярностью или процентной концентрацией, используйте наш Калькулятор разбавления — молярность, проценты.
Если вы хотите выполнить коэффициент разбавления или кратное разведение для расчетов растворов с молярностью или процентной концентрацией, используйте наш Калькулятор коэффициента разбавления — молярность, проценты.
Уравнения с процентным решением
| (уравнение 1) | |
| (уравнение 2) | |
| (уравнение 3) |
Как отмечалось выше, вес относится к массе (т. е. измеренной на весах). При изучении уравнения для каждого из приведенных выше процентных растворов очень важно отметить, что во всех случаях знаменатель относится к массе или объему раствора , а не только к массе или объему растворителя. Таким образом, масса раствора представляет собой объединенную массу растворенного вещества и растворителя, а объем раствора представляет собой объединенный объем растворенного вещества и растворителя.
Последнее примечание необходимо при рассмотрении объемных/объемных % растворов. Когда разные объемы идентичного раствора добавляются вместе, конечный объем всегда будет в точности равен сумме добавленных отдельных порций. Например, добавление 50 мл воды к 50 мл воды даст общий объем 100 мл, а добавление 75 мл 100% этанола к 75 мл 100% этанола даст общий объем 150 мл. Однако при смешивании смешивающихся жидкостей (например, воды и этанола) конечный объем раствора не совсем равен сумме отдельных объемов. Например, при добавлении 50 мл этанола к 50 мл воды общий объем будет меньше 100 мл. на самом деле ближе к 96 мл. Поэтому при приготовлении растворов объем/объем в процентах всегда лучше растворить растворенное вещество в растворителе, а затем добавить дополнительное количество растворителя, чтобы довести общий объем раствора до желаемого конечного значения.
Когда разные объемы идентичного раствора добавляются вместе, конечный объем всегда будет в точности равен сумме добавленных отдельных порций. Например, добавление 50 мл воды к 50 мл воды даст общий объем 100 мл, а добавление 75 мл 100% этанола к 75 мл 100% этанола даст общий объем 150 мл. Однако при смешивании смешивающихся жидкостей (например, воды и этанола) конечный объем раствора не совсем равен сумме отдельных объемов. Например, при добавлении 50 мл этанола к 50 мл воды общий объем будет меньше 100 мл. на самом деле ближе к 96 мл. Поэтому при приготовлении растворов объем/объем в процентах всегда лучше растворить растворенное вещество в растворителе, а затем добавить дополнительное количество растворителя, чтобы довести общий объем раствора до желаемого конечного значения.
Калькулятор процентного решения
Каждая показанная ниже ячейка калькулятора соответствует члену в приведенной выше формуле. Введите соответствующие значения во все ячейки, кроме той, которую вы хотите рассчитать.